Вернакалант
Vernakalant
Фармакологическое действие
Вернакалант — синтетический антиаритмический препарат Ⅲ класса. Вернакалант действует преимущественно на предсердия, увеличивая продолжительность рефрактерного периода предсердий и частотно-зависимо замедляя проводимость импульсов. Считается, что это антифибрилляционное влияние на рефрактерность и проводимость подавляет механизм возбуждения, усиливает действие на предсердие во время фибрилляции предсердий. Предполагается, что относительная селективность действия вернакаланта на рефрактерный период предсердий, а не желудочков, возникает благодаря блокированию токов в предсердиях, но не в желудочках, а также вследствие уникального электрофизиологического состояния фибриллирующего предсердия. Однако была зарегистрирована блокада катионных токов, в том числе каналов hERG и потенциалозависимых натриевых каналов, присутствующих в желудочках.
Вернакалант блокирует токи во всех фазах предсердного потенциала действия, в том числе калиевые токи, которые специфически проявляются в предсердиях (например, воздействуя на сверхбыстрые компоненты замедленного выпрямляющего и ацетилхолин-зависимого калиевого тока). Во время фибрилляции предсердий частотно- и потенциалзависимая блокада натриевых каналов в дальнейшем фокусирует действие препарата относительно быстро активирующейся и частично деполяризированной ткани предсердия, а не относительно биения желудочков нормальной поляризации, частота сокращений которых ниже. Дополнительно, способность вернакаланта блокировать поздний компонент натриевого тока ограничивает влияние на реполяризацию желудочков, вызываемую блокадой калиевых токов в желудочке. Направленное действие на ткани предсердия в сочетании с блокированием позднего натриевого тока предполагает низкий проаритмический потенциал вернакаланта. В целом, комбинация действия вернакаланта на калиевые и натриевые токи приводит к значительному антиаритмическому эффекту, который, главным образом, концентрируется в предсердиях.
В исследованиях электрофизиологии у пациентов вернакалант дозозависимо пролонгировал эффективный рефрактерный период предсердий, что не ассоциировалось с существенным увеличением эффективного рефрактерного периода желудочков.
Фармакокинетика
Абсорбция
У пациентов средние максимальные концентрации вернакаланта в плазме крови составили 3,9 мкг/мл после однократной 10-минутной инфузии вернакаланта гидрохлорида в дозе 3 мг/кг и 4,3 мкг/мл после второй инфузии в дозе 2 мг/кг с 15-минутным интервалом между введениями.
Распределение
Вернакалант экстенсивно и быстро распределяется в организме; Vd (объём распределения) составляет приблизительно 2 л/кг. Показатели Cmax (максимальная плазменная концентрация) и AUC (Area under the plasma drug concentration-time curve — площадь под кривой «концентрация-время») были пропорциональными дозе при дозировке в диапазоне 0,5–5 мг/кг. У пациентов типичный общий клиренс вернакаланта из организма составляет 0,41 л/ч/кг. Свободная фракция вернакаланта в сыворотке крови человека составляет 53–63 % в диапазоне концентрации 1–5 мкг/мл.
Элиминация
Вернакалант преимущественно выводится путём О-деметилирования, опосредованного CYP2D6 у пациентов с экстенсивным метаболизмом CYP2D6. У пациентов с медленным метаболизмом CYP2D6 основными механизмами выведения являются глюкуронидация и выведение почками. Средний период полувыведения вернакаланта составляет приблизительно 3 часа у пациентов с быстрым метаболизмом CYP2D6 и около 5,5 часа у пациентов с медленным метаболизмом CYP2D6.
Отдельные группы пациентов
Пол, застойная сердечная недостаточность в анамнезе, нарушение функции почек в анамнезе, одновременное применение бета-блокаторов и других препаратов, в том числе варфарина, метопролола, фуросемида и дигоксина, не оказывают значительного влияния на фармакокинетику вернакаланта. У пациентов с нарушением функции печени экспозиция повышается на 9–25 %. Нет необходимости в коррекции дозы вернакаланта при указанных выше состояниях, а также в зависимости от возраста, уровней креатинина сыворотки крови или скорости метаболизма CYP2D6.
Показания
Быстрое восстановление синусового ритма при недавно возникшей фибрилляции предсердий у взрослых:
- у пациентов, не подвергавшихся оперативному вмешательству: при длительности фибрилляции предсердий ≤7 дней;
- у пациентов, перенёсших операцию на сердце: при длительности фибрилляции предсердий ≤3 дней.
Противопоказания
- Повышенная чувствительность к вернакаланту;
- пациенты с тяжёлым аортальным стенозом, пациенты с систолическим давлением <100 мм рт. ст. и пациенты с сердечной недостаточностью IV и III класса по NYHA;
- пациенты с удлиненным интервалом QT в исходном состоянии (неоткорректированный >440 мсек) или тяжёлой брадикардией, нарушением функции синусового узла или блокадой сердца второй и третьей степени при отсутствии водителя ритма;
- применение внутривенных антиаритмических препаратов для контроля ритма (I и III классов) за 4 часа до применения вернакаланта, а также в первые 4 часа после введения препарата;
- острый коронарный синдром (включая инфаркт миокарда) в течение предшествующих 30 дней.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и строго контролируемых исследований по безопасности применения вернакаланта при беременности у человека не проведено.
В качестве меры предосторожности предпочтительно избегать применения вернакаланта в период беременности.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения вернакаланта в период грудного вскармливания не проведено.
Неизвестно, выделяется ли вернакалант и его метаболиты с грудным молоком у человека. Нельзя исключать риск для детей, находящихся на грудном вскармливании.
Способ применения и дозы
Парентерально, перорально.
Побочные действия
Определение частоты побочных эффектов: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1 000 и <1/100); редко (≥1 /10 000 и <1/1 000); очень редко (<1/10 000, включая отдельные случаи).
Со стороны нервной системы
Очень часто — дисгевзия; часто — парестезия, головокружение, гипестезия; нечасто — чувство жжения, паросмия, сонливость, вазовагальный обморок.
Со стороны органа зрения
Нечасто — раздражение слизистой оболочки глаз, увеличение слезоотделения, нарушение зрения.
Со стороны сердечной деятельности
Часто — брадикардия, трепетание предсердий; нечасто — блокада синусового узла, полная АV блокада, AV блокада I степени, блокада левой ножки пучка Гиса, блокада правой ножки пучка Гиса, желудочковые экстрасистолы, трепетания, синусовая брадикардия, желудочковая тахикардия, удлиненный комплекс QRS на ЭКГ, пролонгация QT на ЭКГ, кардиогенный шок.
Со стороны сосудистой системы
Часто — гипотензия; нечасто — приливы крови, бледность, повышение диастолического артериального давления.
Респираторные, торакальные и медиастинальные расстройства
Очень часто — чихание; часто — кашель, дискомфорт в носу; нечасто — диспноэ, асфиксия, ринорея, першение в горле, ощущение удушья, заложенность носа.
Желудочно-кишечные расстройства
Часто — тошнота, рвота, оральная парестезия; нечасто — сухость во рту, оральная гипестезия, диарея, позывы к дефекации.
Расстройства кожи и подкожной ткани
Часто — зуд, гипергидроз; нечасто — генерализованный зуд, холодный пот.
Расстройства скелетно-мышечной и соединительной ткани
Нечасто — боль в конечностях.
Расстройства общего характера и состояние места ввода препарата
Часто — боль в месте введения препарата, жар; нечасто — раздражение, гиперчувствительность, парестезия, чувство дискомфорта, чувство дискомфорта в груди, утомляемость.
Передозировка
Симптомы
Не было случаев передозировки вернакаланта в клинических исследованиях. Получено единичное сообщение о случайной передозировке 3 мг/кг в течение 5 минут (вместо 10 минут), в результате чего наблюдалась гемодинамически стабильная тахикардия с широкими желудочковыми комплексами на кардиограмме, которая впоследствии разрешилась без осложнений.
Лечение
Специфический антидот неизвестен, при передозировке требуется постоянный кардиомониторинг, контроль гемодинамики и общего состояния, при необходимости симптоматическая терапия.
Взаимодействие
Исследований взаимодействия инъекционных форм вернакаланта с другими препаратами не проводилось. Приём других пероральных антиаритмических препаратов отменяют на 2 часа после введения вернакаланта. Затем можно возобновить или начать приём пероральных поддерживающих антиаритмических препаратов.
Хотя вернакалант является субстратом CYP2D6, популяционный фармакокинетический анализ продемонстрировал отсутствие существенных отличий при острой экспозиции вернакаланта (Cmax и AUC0–90 мин), если слабые или мощные ингибиторы CYP2D6 применяли на протяжении 1 дня до внутривенного введения вернакаланта по сравнению с пациентами, которые одновременно не принимали ингибиторы CYP2D6. Кроме того, острая экспозиция вернакаланта у пациентов с медленным метаболизмом CYP2D6 лишь минимально отличалась от таковой у пациентов с быстрым метаболизмом. Не требуется коррекции дозы вернакаланта в зависимости от скорости метаболизма CYP2D6 или при применении вернакаланта одновременно с ингибиторами 2D6.
Вернакалант — умеренный, конкурентный ингибитор CYP2D6. Однако при неотложном внутривенном введении вернакаланта не ожидается выраженного влияния на фармакокинетику постоянно применяемых субстратов 2D6 по причине краткого периода полураспада вернакаланта и последующего преходящего характера ингибирования 2D6.
Не ожидается возникновение существенных взаимодействий с другими препаратами при инфузионном введении вернакаланта по причине быстрого распределения и преходящей экспозиции, низкого уровня связывания с белками, отсутствия способности ингибировать другие ферменты (CYP3A4, 1A2, 2C9, 2C19 и 2E1) и Р-гликопротеин в исследовании транспорта дигоксина.
Несовместимость
Инъекционные формы препарата нельзя смешивать с другими лекарственными средствами, за исключением растворителей, указанных в разделе «Способ применения и дозы» соответствующей лекарственной формы.
Меры предосторожности
Сообщалось о серьёзных случаях развития артериальной гипотензии во время инфузии вернакаланта и непосредственно после её проведения. Необходимо обеспечить тщательное наблюдение за состоянием пациента с оценкой жизненно-важных показателей и постоянный мониторинг сердечного ритма во время введения препарата и на протяжении, как минимум, 15 минут после завершения инфузии.
Если появляется какой-либо из указанных ниже признаков и симптомов, введение вернакаланта следует прекратить и назначить пациенту соответствующее медикаментозное лечение:
- Внезапное снижение артериального давления или уменьшение частоты сердечных сокращений (с/без симптоматической артериальной гипотензии или брадикардии);
- Артериальная гипотензия;
- Брадикардия;
- Изменения на ЭКГ (например, клинически значимая синусовая пауза, полная блокада сердца, новая блокада ножки пучка Гиса, значительное удлинение интервала QRS или QT, изменения, указывающие на ишемию или инфаркт, желудочковая аритмия).
Если такие явления возникают во время первой инфузии вернакаланта, вторую инфузию проводить не следует.
Состояние пациента следует в дальнейшем контролировать на протяжении 2 часов после начала инфузии и до достижения стабилизации клинических показателей и ЭКГ.
При отсутствии терапевтического ответа на введение вернакаланта можно рассмотреть вопрос о проведении кардиоверсии постоянным током. Нет клинического опыта проведения кардиоверсии постоянным током менее чем через 2 часа после применения препарата.
Перед проведением фармакологической кардиоверсии следует убедиться, что у пациента адекватные гидратация и гемодинамические показатели; если необходимо, следует назначить антикоагулянты в соответствии с рекомендациями по лечению. У пациентов с гипокалиемией (уровни калия в сыворотке крови ниже 3,5 ммоль/л) перед введением вернакаланта следует нормализовать уровень калия.
Гипотензия
У некоторых пациентов может возникать гипотензия (вернакалант 7,6 %, плацебо 5,1 %). Гипотензия обычно развивается на раннем этапе — во время проведения инфузии или сразу после завершения инфузии, и, как правило, устраняется проведением стандартных поддерживающих процедур. Нечасто наблюдались случаи тяжёлой гипотензии. Пациенты с застойной сердечной недостаточностью (ЗСН) определены как группа высокого риска в отношении развития гипотензии.
Во время инфузии и, по крайней мере, в течение 15 минут после окончания проведения инфузии необходимо наблюдать состояние пациента относительно появления признаков и симптомов внезапного снижения артериального давления или уменьшения частоты сердечных сокращений.
Застойная сердечная недостаточность (ЗСН)
У пациентов с ЗСН более высокая общая частота развития гипотензии на протяжении первых 2 часов после введения вернакаланта, по сравнению с пациентами, получавшими плацебо (16,1 % и 4,7 %, соответственно). Разница в частоте возникновения гипотензии в первые 2 часа после введения вернакаланта у пациентов с ЗСН по сравнению с пациентами, получавшими плацебо, была незначительной (5,7 % по сравнению с 5,2 %). О гипотензии как о серьезной побочной реакции или как о причине отмены препарата сообщалось у 2,9 % пациентов с ЗСН после применения вернакаланта, в то время как в плацебо группе у пациентов с ЗСН гипотензия не встречалась.
У пациентов с ЗСН в анамнезе отмечена более высокая частота возникновения желудочковой аритмии в первые 2 часа после введения препарата (вернакалант — 7,3 %, плацебо — 1,6 %). Как правило, эти аритмии были бессимптомными, мономорфными, непродолжительными (в среднем 3–4 удара) желудочковыми тахикардиями. Однако сообщалось о подобной частоте возникновения желудочковой аритмии и у пациентов без ЗНС в анамнезе после применения вернакаланта или плацебо (вернакалант — 3,2 %, плацебо — 3,6 %).
По причине более высокой частоты возникновения таких побочных реакций, как гипотензия и желудочковая аритмия у пациентов с ЗНС, необходимо с осторожностью применять вернакалант у пациентов с гемодинамически стабильными показателями и ЗНС Ⅰ–Ⅱ функционального класса по NYHA. Ограничен опыт применения вернакаланта у пациентов с ранее зафиксированным показателем фракции выброса левого желудочка ≤35 %. Применять препарат у таких пациентов не рекомендовано. Препарат противопоказан пациентам с ЗНС Ⅲ или Ⅳ функционального класса по NYHA.
Трепетание предсердий
Не установлено, что вернакалант эффективен в восстановлении синусового ритма при трепетании предсердий. У пациентов, получающих вернакалант, более высокая частота преобразования в трепетание предсердий в первые 2 часа после введения препарата. Такой риск выше у пациентов, принимающих антиаритмические препараты Ⅰ класса. Если наблюдается трепетание предсердий на фоне лечения, следует рассмотреть вопрос о продолжении инфузии.
Применение антиаритмических препаратов до или после введения вернакаланта
Не рекомендуется применять препарат у пациентов, которым за 4–24 часа до применения вернакаланта вводили внутривенно антиаритмические препараты (Ⅰ и Ⅲ классов), поскольку данных недостаточно. Препарат не следует применять у пациентов, которым внутривенно вводили антиаритмические препараты (Ⅰ и Ⅲ классов) на протяжении 4 часов до применения вернакаланта.
С осторожностью следует применять вернакалант у пациентов, принимающих пероральные антиаритмические препараты (Ⅰ и Ⅲ класса), поскольку опыт применения ограничен. Риск возникновения трепетания предсердий может быть повышенным у пациентов, получающих антиаритмические препараты Ⅰ класса.
Имеется ограниченный опыт применения внутривенных антиаритмических препаратов для контроля ритма (Ⅰ и Ⅲ классов) в первые 4 часа после введения вернакаланта, поэтому на протяжении этого периода такие препараты применять не следует.
Через 2 часа после введения вернакаланта можно рассмотреть вопрос о возобновлении или начале применения пероральных поддерживающих антиаритмических препаратов.
Заболевания клапанов сердца
У пациентов с заболеванием клапана сердца чаще возникала желудочковая аритмия при применении вернакаланта. Такие пациенты требуют более тщательного мониторинга.
Другие заболевания и состояния, которые не изучались
Не наблюдалось повышения риска возникновения желудочковой тахикардии типа «пируэт» при применении вернакаланта у пациентов с неоткорректированным интервалом QT менее 440 мс.
Кроме того, отсутствуют данные применения вернакаланта у пациентов с клинически значимым клапанным стенозом, гипертрофической обструктивной кардиомиопатией, рестриктивной кардиомиопатией или констриктивным перикардитом, поэтому в таких случаях препарат применять не рекомендовано. Опыт применения вернакаланта у пациентов с водителем ритма ограничен.
Поскольку опыт использования препарата в клинических исследованиях у пациентов с терминальной стадией нарушения функции печени ограничен, вернакалант не рекомендован таким пациентам.
Лекарственный препарат содержит приблизительно 1,4 ммоль (32 мг) натрия в каждом флаконе по 200 мг. Каждый флакон по 500 мг содержит приблизительно 3,5 ммоль (80 мг) натрия. Эту информацию следует учитывать у пациентов, которые контролируют употребление натрия с пищей.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследования влияния вернакаланта на способность управлять автотранспортом и механизмами не проводились. Однако при управлении автотранспортом и механизмами следует помнить, что сообщалось о возникновении головокружения в течение первых двух часов после введения вернакаланта.
Классификация
-
АТХ
C01BG11
-
Фармакологическая группа
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Вернакалант предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Вернакалант, содержатся в инструкции производителя, прилагаемой к упаковке.
Бринэвис
МНН: Вернакалант
Производитель: Гамельн Фармасьютикалс ГмбХ
Анатомо-терапевтическо-химическая классификация: Вернакалант
Номер регистрации в РК:
№ РК-ЛС-5№019985
Информация о регистрации в РК:
28.06.2013 — 28.06.2018
- Скачать инструкцию медикамента
Торговое название
Бринэвис
Международное непатентованное название
Вернакалант
Лекарственная форма
Концентрат для приготовления раствора для инфузий, 20 мг/мл
Состав
1 мл концентрата содержит
активное вещество: вернакаланта гидрохлорид 20 мг,
вспомогательные вещества: лимонной кислоты моногидрат, натрия хлорид, натрия гидроксид, вода для инъекций.
Описание
Прозрачная бесцветная жидкость без видимых механических включений.
Фармакотерапевтическая группа
Препараты для лечения заболеваний сердца. Антиаритмические препараты I и III классов. Прочие антиаритмические препараты I класса. Вернакалант.
Код АТХ C01BG11
Фармакологические свойства
Фармакокинетика
Всасывание. У пациентов средние максимальные концентрации вернакаланта в плазме крови составили 3,9 мкг/мл после однократной 10-минутной инфузии вернакаланта гидрохлорида в дозе 3 мг/кг и 4,3 мкг/мл после второй инфузии в дозе 2 мг/кг с 15‑минутным интервалом между введениями.
Распределение Вернакалант экстенсивно и быстро распределяется в организме; объем распределения составляет приблизительно 2 л/кг. Показатели Сmax и AUC были пропорциональными дозе при дозировке в диапазоне 0,5 мг/кг – 5 мг/кг. У пациентов типичный общий клиренс вернакаланта из организма составляет 0,41 л/ч/кг. Свободная фракция вернакаланта в сыворотке крови человека составляет 53 – 63% в диапазоне концентрации 1 – 5 мкг/мл.
Выведение/выделение. Вернакалант преимущественно выводится путем О‑деметилирования, опосредованного CYP2D6 у пациентов с экстенсивным метаболизмом CYP2D6. У пациентов с медленным метаболизмом CYP2D6 основными механизмами выведения являются глюкуронидация и выведение почками. Средний период полувыведения вернакаланта составляет приблизительно 3 часа у пациентов с быстрым метаболизмом CYP2D6 и около 5,5 часа у пациентов с медленным метаболизмом CYP2D6.
Отдельные группы пациентов
Пол, застойная сердечная недостаточность в анамнезе, нарушение функции почек в анамнезе, одновременное применение бета-блокаторов и других препаратов, в том числе варфарина, метопролола, фуросемида и дигоксина, не оказывают значительного влияния на фармакокинетику Бринэвиса. У пациентов с нарушением функции печени экспозиция повышается на 9–25%. Нет необходимости в коррекции дозы препарата Бринэвис при указанных выше состояниях, а также в зависимости от возраста, уровней креатинина сыворотки крови или скорости метаболизма CYP2D6.
Фармакодинамика
Механизм действия. Вернакалант – антиаритмический препарат, который действует преимущественно на предсердия, увеличивая продолжительность рефрактерного периода предсердий и частотно-зависимо замедляя проводимость импульсов. Считается, что это антифибрилляционное влияние на рефрактерность и проводимость подавляет механизм возбуждения, усиливает действие на предсердие во время фибрилляции предсердий. Предполагается, что относительная селективность действия вернакаланта на рефрактерный период предсердий, а не желудочков, возникает благодаря блокированию токов в предсердиях, но не в желудочках, а также вследствие уникального электрофизиологического состояния фибриллирующего предсердия. Однако была зарегистрирована блокада катионных токов, в том числе каналов hERG и потенциалозависимых натриевых каналов, присутствующих в желудочках.
Вернакалант блокирует токи во всех фазах предсердного потенциала действия, в том числе калиевые токи, которые специфически проявляются в предсердиях (например, воздействуя на сверхбыстрые компоненты замедленного выпрямляющего и ацетилхолин-зависимого калиевого тока). Во время фибрилляции предсердий частотно- и потенциалзависимая блокада натриевых каналов в дальнейшем фокусирует действие препарата относительно быстро активирующейся и частично деполяризированной ткани предсердия, а не относительно биения желудочков нормальной поляризации, частота сокращений которых ниже. Дополнительно, способность вернакаланта блокировать поздний компонент натриевого тока ограничивает влияние на реполяризацию желудочков, вызываемую блокадой калиевых токов в желудочке. Направленное действие на ткани предсердия в сочетании с блокированием позднего натриевого тока предполагает низкий проаритмический потенциал вернакаланта. В целом, комбинация действия вернакаланта на калиевые и натриевые токи приводит к значительному антиаритмическому эффекту, который, главным образом, концентрируется в предсердиях.
В исследованиях электрофизиологии у пациентов вернакалант дозозависимо пролонгировал эффективный рефрактерный период предсердий, что не ассоциировалось с существенным увеличением эффективного рефрактерного периода желудочков.
Показания к применению
Быстрое восстановление синусового ритма при недавно возникшей фибрилляции предсердий у взрослых:
-
у пациентов, не подвергавшихся оперативному вмешательству: при длительности фибрилляции предсердий ≤ 7 дней
-
у пациентов, перенесших операцию на сердце: при длительности фибрилляции предсердий ≤ 3 дней
Способ применения и дозы
Бринэвис следует вводить в виде внутривенной инфузии, в контролируемых клинических условиях, приспособленных для проведения кардиоверсии. Инфузию препарата Бринэвис должен проводить только квалифицированный медицинский персонал, а во время инфузии и, по крайней мере, в течение 15 минут после окончания проведения инфузии следует часто контролировать состояние пациента относительно появления признаков и симптомов внезапного снижения артериального давления или уменьшения частоты сердечных сокращений.
Дозировка
Дозу препарата Бринэвис рассчитывают по массе тела пациента, максимальный вес для расчета дозы соответствует 113 кг.
Рекомендованная доза начальной инфузии составляет 3 мг/кг в течение 10 минут. Для пациентов с массой тела ≥ 113 кг максимальная начальная доза не должна превышать 339 мг (84,7 мл раствора в концентрации 4 мг/мл). Если конверсия в синусовый ритм не произошла в течение 15 минут после окончания начальной инфузии, можно выполнить повторную инфузию в дозе 2 мг/кг в течение 10 минут. Для пациентов с массой тела ≥ 113 кг максимальная повторная доза не должна превышать 226 мг (56,5 мл раствора в концентрации 4 мг/мл). Суммарная доза в течение 24 часов не должна превышать 5 мг/кг. Нет клинических данных о введении повторных доз после первой и второй инфузии. Через 24 часа уровни вернакаланта становятся незначительными.
Если конверсия в синусовый ритм произошла во время первой или второй инфузии, инфузию следует завершить. Если наблюдается гемодинамически стабильное трепетание предсердий после первой инфузии, можно выполнить повторную инфузию препарата Бринэвис, поскольку у пациентов возможна конверсия в синусовый ритм.
Для введения препарата предпочтительно использовать инфузионную помпу. Однако можно применять и шприцевую помпу, при условии, что рассчитанный объем будет введен на протяжении указанного времени.
Не вводить внутривенно струйно или болюсно.
В качестве растворителя рекомендовано использовать 0,9 % раствор натрия хлорида для инъекций, раствор Рингера с лактатом для инъекций или 5 % глюкозу для инъекций.
Перед введением препарата необходимо ознакомиться со всеми этапами приготовления к проведению инфузии.
Приготовление препарата Бринэвис для инфузии
Этап 1: Перед применением флаконы препарата Бринэвис проверьте визуально на присутствие механических примесей и изменение цвета. Нельзя использовать флаконы с признаками механических примесей или изменения цвета.
Примечание. Концентрат Бринэвис для приготовления раствора для инфузий имеет цвет от бесцветного до бледно-желтого. Оттенки цвета в данном диапазоне не влияют на активность препарата.
Этап 2: Разведение концентрата. Для гарантии правильного введения необходимо приготовить достаточное количество препарата Бринэвис в концентрации 20 мг/мл перед началом терапии для проведения первой или второй инфузии, если она понадобится.
Необходимо приготовить раствор в концентрации 4 мг/мл в соответствии с указанными ниже инструкциями:
Пациенты с массой тела ≤100 кг: 25 мл препарата Бринэвис в концентрации 20 мг/мл добавить к 100 мл растворителя.
Пациенты весом >100 кг: 30 мл препарата Бринэвис в концентрации 20 мг/мл добавить к 120 мл растворителя.
Этап 3: Осмотр раствора. Разведенный стерильный раствор должен быть прозрачным от бесцветного до бледно-желтого цвета. Перед использованием визуально еще раз проверьте раствор на присутствие механических примесей и изменение цвета.
Способ применения.
Флаконы препарата Бринэвис предназначены только для одноразового использования; препарат должен быть разведен перед применением. Разведенный стерильный концентрат химически и физически стабилен в течение 12 часов при температуре не выше 25° C.
С микробиологической точки зрения препарат следует использовать немедленно. Если препарат не используется немедленно, за сроки и условия хранения препарата ответственность несет потребитель, и они не должны превышать 24 часа при температуре 2–8° С, за исключением случаев, когда разведение препарата проводится в контролируемых и валидированных асептических условиях.
Этап 4: Проведение первой инфузии.
Первую инфузию препарата Бринэвис в дозе 3 мг/кг проводят в течение 10 минут. На протяжении этого периода состояние пациента следует тщательно наблюдать относительно появления признаков и симптомов внезапного снижения артериального давления или уменьшения частоты сердечных сокращений. Если появляются такие признаки (с/без симптоматической артериальной гипотензии или брадикардии), инфузию следует немедленно прекратить.
Этап 5: Наблюдение за состоянием пациента. Если конверсия в синусовый ритм не произошла, следует проводить наблюдение основных показателей жизненно-важных функций организма и сердечного ритма пациента в течение дополнительных 15 минут.
Этап 6: Проведение второй инфузии. Если конверсия в синусовый ритм не произошла при проведении первой инфузии или в течение 15 минут наблюдения, проводят вторую инфузию в дозе 2 мг/кг в течение 10 минут.
Суммарные дозы свыше 565 мг не изучались.
Пациенты, перенесшие операцию на сердце
Нет необходимости в коррекции дозы.
Нарушение функции почек
Нет необходимости в коррекции дозы.
Нарушение функции печени
Нет необходимости в коррекции дозы.
Пациенты пожилого возраста (≥ 65 лет).
Нет необходимости в коррекции дозы.
Дети
Не рекомендуется применять препарат у детей младше 18 лет, в связи недостаточностью данных об эффективности и безопасности в данной возрастной группе.
Побочные действия
Частота возникновения побочных эффектов определенная как очень часто ≥ 1/10, часто ≥ 1/100 < 1/10, нечасто ≥ 1/1000 < 1/100
Расстройства нервной системы
Очень часто: дисгевзия
Часто: парестезия; головокружение; гипестезия
Нечасто: чувство жжения; паросмия; сонливость; вазовагальный обморок
Расстройства зрения
Нечасто: раздражение слизистой оболочки глаз; увеличение слезоотделения; нарушение зрения
Расстройства сердечной деятельности
Часто: брадикардия; трепетание предсердий
Нечасто: блокада синусового узла; полная АV блокада; AV блокада первой степени; блокада левой ножки пучка Гиса; блокада правой ножки пучка Гиса; желудочковые экстрасистолы; трепетания; синусовая брадикардия; желудочковая тахикардия; удлиненный комплекс QRS на ЭКГ; пролонгация QT на ЭКГ; кардиогенный шок
Сосудистые расстройства
Часто: гипотензия
Нечасто: приливы крови; бледность, повышение диастолического артериального давления
Респираторные, торакальные и медиастинальные расстройства
Очень часто: чихание
Часто: кашель; дискомфорт в носу
Нечасто: диспноэ; асфиксия; ринорея; першение в горле; ощущение удушья; заложенность носа
Желудочно-кишечные расстройства
Часто: тошнота; рвота; оральная парестезия
Нечасто: сухость во рту; оральная гипестезия, диарея; позывы к дефекации;
Расстройства кожи и подкожной ткани
Часто: зуд; гипергидроз
Нечасто: генерализованный зуд; холодный пот
Расстройства скелетно-мышечной и соединительной ткани
Нечасто: боль в конечностях
Расстройства общего характера и состояние места ввода препарата
Часто: боль в месте введения препарата; жар
Нечасто: раздражение, гиперчувствительность, парестезия; чувство дискомфорта; чувство дискомфорта в груди; утомляемость
Противопоказания
-
повышенная чувствительность к активному веществу или любому другому компоненту препарата
-
пациенты с тяжелым аортальным стенозом, пациенты с систолическим давлением < 100 мм рт. ст. и пациенты с сердечной недостаточностью IV и III класса по NYHA
-
пациенты с удлиненным интервалом QT в исходном состоянии (неоткорректированный > 440 мсек) или тяжелой брадикардией, нарушением функции синусового узла или блокадой сердца второй и третьей степени при отсутствии водителя ритма
-
применение внутривенных антиаритмических препаратов для контроля ритма (I и III классов) за 4 часа до применения препарата Бринэвис, а также в первые 4 часа после введения препарата Бринэвис
-
острый коронарный синдром (включая инфаркт миокарда) в течение предшествующих 30 дней.
Лекарственные взаимодействия
Исследований взаимодействия инъекционных форм вернакаланта с другими препаратами не проводилось. Прием других пероральных антиаритмических препаратов отменяют на 2 часа после введения Бринэвиса. Затем можно возобновить или начать прием пероральных поддерживающих антиаритмических препаратов.
Хотя вернакалант является субстратом CYP2D6, популяционный фармакокинетический анализ продемонстрировал отсутствие существенных отличий при острой экспозиции вернакаланта (Сmax и AUC0-90мин), если слабые или мощные ингибиторы CYP2D6 применяли на протяжении 1 дня до внутривенного введения вернакаланта по сравнению с пациентами, которые одновременно не принимали ингибиторы CYP2D6. Кроме того, острая экспозиция вернакаланта у пациентов с медленным метаболизмом CYP2D6 лишь минимально отличалась от таковой у пациентов с быстрым метаболизмом. Не требуется коррекции дозы вернакаланта в зависимости от скорости метаболизма CYP2D6 или при применении вернакаланта одновременно с ингибиторами 2D6.
Вернакалант – умеренный, конкурентный ингибитор CYP2D6. Однако при неотложном внутривенном введении вернакаланта не ожидается выраженного влияния на фармакокинетику постоянно применяемых субстратов 2D6 по причине краткого периода полураспада вернакаланта и последующего преходящего характера ингибирования 2D6.
Не ожидается возникновение существенных взаимодействий с другими препаратами при инфузионном введении вернакаланта по причине быстрого распределения и преходящей экспозиции, низкого уровня связывания с белками, отсутствия способности ингибировать другие ферменты (CYP3A4, 1A2, 2C9, 2C19 и 2E1) и Р-гликопротеин в исследовании транспорта дигоксина.
Несовместимость
Данный препарат нельзя смешивать с другими лекарственными средствами, за исключением растворителей, указанных в разделе «Способ применения и дозы».
Особые указания
Сообщалось о серьезных случаях развития артериальной гипотензии во время инфузии препарата Бринэвис и непосредственно после ее проведения. Необходимо обеспечить тщательное наблюдение за состоянием пациента с оценкой жизненно-важных показателей и постоянный мониторинг сердечного ритма во время введения препарата и на протяжении, как минимум, 15 минут после завершения инфузии.
Если появляется какой-либо из указанных ниже признаков и симптомов, введение препарата Бринэвис следует прекратить и назначить пациенту соответствующее медикаментозное лечение:
-
Внезапное снижение артериального давления или уменьшение частоты сердечных сокращений (с/без симптоматической артериальной гипотензии или брадикардии);
-
Артериальная гипотензия;
-
Брадикардия;
-
Изменения на ЭКГ (например, клинически значимая синусовая пауза, полная блокада сердца, новая блокада ножки пучка Гиса, значительное удлинение интервала QRS или QT, изменения, указывающие на ишемию или инфаркт, желудочковая аритмия).
Если такие явления возникают во время первой инфузии препарата Бринэвис, вторую инфузию проводить не следует.
Состояние пациента следует в дальнейшем контролировать на протяжении 2 часов после начала инфузии и до достижения стабилизации клинических показателей и ЭКГ.
При отсутствии терапевтического ответа на введение Бринэвиса можно рассмотреть вопрос о проведении кардиоверсии постоянным током. Нет клинического опыта проведения кардиоверсии постоянным током менее чем через 2 часа после применения препарата.
Перед проведением фармакологической кардиоверсии следует убедиться, что у пациента адекватные гидратация и гемодинамические показатели; если необходимо, следует назначить антикоагулянты в соответствии с рекомендациями по лечению. У пациентов с гипокалиемией (уровни калия в сыворотке крови ниже 3,5 ммоль/л) перед введением Бринэвиса следует нормализовать уровень калия.
Гипотензия
У некоторых пациентов может возникать гипотензия (вернакалант 7,6%, плацебо 5,1%). Гипотензия обычно развивается на раннем этапе – во время проведения инфузии или сразу после завершения инфузии, и, как правило, устраняется проведением стандартных поддерживающих процедур. Нечасто наблюдались случаи тяжелой гипотензии. Пациенты с застойной сердечной недостаточностью (ЗСН) определены как группа высокого риска в отношении развития гипотензии.
Во время инфузии и, по крайней мере, в течение 15 минут после окончания проведения инфузии необходимо наблюдать состояние пациента относительно появления признаков и симптомов внезапного снижения артериального давления или уменьшения частоты сердечных сокращений.
Застойная сердечная недостаточность (ЗСН)
У пациентов с ЗСН более высокая общая частота развития гипотензии на протяжении первых 2 часов после введения вернакаланта, по сравнению с пациентами, получавшими плацебо (16,1% и 4,7%, соответственно). Разница в частоте возникновения гипотензии в первые 2 часа после введения вернакаланта у пациентов с ЗСН по сравнению с пациентами, получавшими плацебо, была незначительной (5,7% по сравнению с 5,2%). О гипотензии как о серьезной побочной реакции или как о причине отмены препарата сообщалось у 2,9% пациентов с ЗСН после применения препарата Бринэвис, в то время как в плацебо группе у пациентов с ЗСН гипотензия не встречалась.
У пациентов с ЗСН в анамнезе отмечена более высокая частота возникновения желудочковой аритмии в первые 2 часа после введения препарата (Бринэвис – 7,3%, плацебо – 1,6%). Как правило, эти аритмии были бессимптомными, мономорфными, непродолжительными (в среднем 3–4 удара) желудочковыми тахикардиями. Однако сообщалось о подобной частоте возникновения желудочковой аритмии и у пациентов без ЗНС в анамнезе после применения препарата Бринэвис или плацебо (Бринэвис – 3,2%, плацебо – 3,6%).
По причине более высокой частоты возникновения таких побочных реакций, как гипотензия и желудочковая аритмия у пациентов с ЗНС, необходимо с осторожностью применять вернакалант у пациентов с гемодинамически стабильными показателями и ЗНС I–II функционального класса по NYHA. Ограничен опыт применения вернакаланта у пациентов с ранее зафиксированным показателем фракции выброса левого желудочка ≤ 35%. Применять препарат у таких пациентов не рекомендовано. Препарат противопоказан пациентам с ЗНС III или IV функционального класса по NYHA.
Трепетание предсердий
Не установлено, что препарат Бринэвис эффективен в восстановлении синусового ритма при трепетании предсердий. У пациентов, получающих препарат Бринэвис, более высокая частота преобразования в трепетание предсердий в первые 2 часа после введения препарата. Такой риск выше у пациентов, принимающих антиаритмические препараты I класса. Если наблюдается трепетание предсердий на фоне лечения, следует рассмотреть вопрос о продолжении инфузии.
Применение антиаритмических препаратов до или после введения препарата Бринэвис
Не рекомендуется применять препарат Бринэвис у пациентов, которым за 4–24 часа до применения вернакаланта вводили внутривенно антиаритмические препараты (I и III классов), поскольку данных недостаточно. Препарат Бринэвис не следует применять у пациентов, которым внутривенно вводили антиаритмические препараты (I и III классов) на протяжении 4 часов до применения вернакаланта.
С осторожностью следует применять препарат Бринэвис у пациентов, принимающих пероральные антиаритмические препараты (I и III класса), поскольку опыт применения ограничен. Риск возникновения трепетания предсердий может быть повышенным у пациентов, получающих антиаритмические препараты I класса.
Имеется ограниченный опыт применения внутривенных антиаритмических препаратов для контроля ритма (I и III классов) в первые 4 часа после введения препарата Бринэвис, поэтому на протяжении этого периода такие препараты применять не следует.
Через 2 часа после введения вернакаланта можно рассмотреть вопрос о возобновлении или начале применения пероральных поддерживающих антиаритмических препаратов.
Заболевания клапанов сердца
У пациентов с заболеванием клапана сердца чаще возникала желудочковая аритмия при применении вернакаланта. Такие пациенты требуют более тщательного мониторинга.
Другие заболевания и состояния, которые не изучались
Не наблюдалось повышения риска возникновения желудочковой тахикардии типа «пируэт» при применении препарата Бринэвис у пациентов с неоткорректированным интервалом QT менее 440 мс.
Кроме того, отсутствуют данные применения препарата Бринэвис у пациентов с клинически значимым клапанным стенозом, гипертрофической обструктивной кардиомиопатией, рестриктивной кардиомиопатией или констриктивным перикардитом, поэтому в таких случаях препарат применять не рекомендовано. Опыт применения препарата Бринэвис у пациентов с водителем ритма ограничен.
Поскольку опыт использования препарата в клинических исследованиях у пациентов с терминальной стадией нарушения функции печени ограничен, вернакалант не рекомендован таким пациентам.
Лекарственный препарат содержит приблизительно 1,4 ммоль (32 мг) натрия в каждом флаконе по 200 мг. Каждый флакон по 500 мг содержит приблизительно 3,5 ммоль (80 мг) натрия. Эту информацию следует учитывать у пациентов, которые контролируют употребление натрия с пищей.
Беременность и период лактации
Отсутствуют данные о применении вернакаланта гидрохлорида у беременных женщин. В качестве меры предосторожности предпочтительно избегать применения вернакаланта в период беременности.
Неизвестно, выделяется ли вернакалант и его метаболиты с грудным молоком у человека. Нельзя исключать риск для детей, находящихся на грудном вскармливании.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Исследования влияния препарата Бринэвис на способность управлять автотранспортом и механизмами не проводились. Однако при управлении автотранспортом и механизмами следует помнить, что сообщалось о возникновении головокружения в течение первых двух часов после введения препарата Бринэвис.
Передозировка
Симптомы: Не было случаев передозировки препарата Бринэвис в клинических исследованиях. Получено единичное сообщение о случайной передозировке 3 мг/кг в течение 5 минут (вместо 10 минут), в результате чего наблюдалась гемодинамически стабильная тахикардия с широкими желудочковыми комплексами на кардиограмме, которая впоследствии разрешилась без осложнений.
Лечение: Специфического антидота нет, при передозировке требуется постоянный кардиомониторинг, контроль гемодинамики и общего состояния, при необходимости симптоматическая терапия.
Форма выпуска и упаковка
По 25 мл во флаконы из прозрачного бесцветного стекла, укупоренные пробками резиновыми, обжатые алюминиевыми колпачками и закрытые сверху пластмассовой крышечкой
1 флакон вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную коробку.
Условия хранения
Хранить при температуре не выше 250 С.
Хранить в недоступном для детей месте.
Срок хранения
3 года
Не применять по истечении срока годности, указанного на упаковке
Условия отпуска из аптек
По рецепту
Производитель
Гамельн Фармасьютикалс ГмбХ., Германия
Упаковщик
Мерк Шарп и Доум Б.В., Нидерланды
Владелец регистрационного удостоверения
Кардиом ЮК Лимитед, Великобритания
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
ТОО «Jetcross» (Джеткросс)
Г. Алматы, ул. Тимирязева, 42, павильон 15/1 офис 1
Тел. +7(727) 269-54-20
E-mail: s.aygul1971@mail.ru
| 654029001477976919_ru.doc | 107 кб |
| 579276041477978094_kz.doc | 141.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
{{ isErrorSetToBasket === false ? ‘Товар добавлен вкорзину’ : ‘Не удалось добавить товар в корзину’}}
Перейти в корзину
{{Object.keys(error)[0]}}:
{{Object.values(error)[0]}}
Продолжить покупки
{{isErrorSetToBasket === true && countBasket != 0 ? » : `(${countBasket})`}}

Вернакалант гидрохлорид
Кат. №: AG00G3QF-5
Цена По запросу
Количество
Вы уже добавили максимально доступное на складе кол-во товара
Достигнуто максимально доступное кол-во
Под заказ
{{!!storageProduct ? ‘На складе’ : ‘Под заказ’}}
Ожидается поставка
Скачать каталог «ХИММЕД» в формате pdf

Химические реактивы

Лабораторное оборудование

Аналитическое оборудование
Биохимия

Проектирование лабораторий
Материалы для микроэлектроники
Для уточнения данных о стоимости и наличии товаров, пожалуйста, обращайтесь к
менеджерам по продажам.
Похоже, что-то пошло не так.
Попробуйте перезагрузить страницу.
×
Авторизация прошла успешно.
| Клинические данные | |
|---|---|
| Торговые наименования | Brinavess |
| Другие имена | RSD1235 |
| Данные лицензии |
|
| Маршруты администрация |
Внутривенно,[1] устный[нужна цитата ] |
| Код УВД |
|
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Связывание с белками | низкий |
| Метаболизм | CYP2D6, глюкуронизация |
| Устранение период полураспада | 3–5,5 часов |
| Идентификаторы | |
|
Название ИЮПАК
|
|
| Количество CAS |
|
| PubChem CID |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| КЕГГ |
|
| Панель управления CompTox (EPA) |
|
| ECHA InfoCard | 100.121.790 |
| Химические и физические данные | |
| Формула | C20ЧАС31NО4 |
| Молярная масса | 349.471 г · моль−1 |
| 3D модель (JSmol ) |
|
|
Улыбки
|
|
|
ИнЧИ
|
|
| |
Вернакалант (ГОСТИНИЦА; Торговое наименование ЕС Brinavess; предлагаемое торговое название в США Кинапид) — фармацевтический препарат для лечения острой конверсии мерцательная аритмия своего рода нерегулярное сердцебиение в виде внутривенная инфузия. Он был одобрен для использования в Европейском Союзе и Великобритании с 2010 года. Управление по контролю за продуктами и лекарствами отказано в утверждении в 2008 и 2019 годах.
Медицинское использование
Препарат применяется для лечения мерцательная аритмия продолжительностью до трех дней у взрослых после операции на сердце или продолжительностью до семи дней у других взрослых в виде внутривенной инфузии.[1]
Противопоказания
Вернакалант противопоказан при ряде сердечных заболеваний: тяжелых. стеноз аорты, низкое кровяное давление (систолический давление ниже 100 мм рт. ст.), сердечная недостаточность (NYHA III – IV класс), удлиненное время QT, суровый брадикардия (медленный пульс), синусовый узел дисфункция, второй или же атриовентрикулярная блокада третьей степени, и острый коронарный синдром включая острое сердечно-сосудистое заболевание. Вернакалант и другие внутривенные препараты для контроля ритма (класс I и антиаритмические препараты III класса ) нельзя давать в течение четырех часов друг после друга.[1]
Побочные эффекты
Наиболее частыми побочными эффектами в исследованиях были: дисгевзия (нарушение вкуса, у 18% пациентов), чихание (13%) и парестезия (аномальные кожные ощущения, 7%); они были временными и редко приводили к прерыванию лечения. Потенциально серьезные побочные эффекты включали низкое кровяное давление и преобразование сердечного ритма в трепетание предсердий вместо нормального синусовый ритм; флаттер в основном подействовал на вторую дозу вернакаланта.[1]
Передозировка
Имеется единичный случай, когда человеку вводили полную дозу веракаланта за половину рекомендуемого времени, что привело к тахикардия (учащенное сердцебиение) без длительных побочных эффектов.[1]
Взаимодействия
Препараты, подавляющие фермент печени CYP2D6 теоретически может увеличивать концентрацию вернакаланта в организме, поскольку последний метаболизируется этим ферментом; но было обнаружено, что это не имеет клинического значения. Хотя сам препарат является умеренным ингибитором CYP2D6, ожидается, что он не окажет существенного влияния на другие фармацевтические препараты, которые расщепляются этим ферментом, поскольку он остается в организме лишь на короткое время. Вернакалант, вероятно, взаимодействует с другими антиаритмическими препаратами, хотя официальных исследований не проводилось.[1]
Фармакология
Механизм действия
Как и другие антиаритмические препараты III класса, блоки вернакалант предсердный калиевые каналы, тем самым продлевая реполяризация. Он отличается от типичных агентов класса III тем, что блокирует определенный тип калиевого канала, кардиальный транзиторный выходящий калиевый ток, с усилением потенции по мере увеличения частоты сердечных сокращений. Это означает, что он более эффективен при высокой частоте сердечных сокращений, в то время как другие препараты класса III имеют тенденцию терять эффективность в этих условиях. Также он немного блокирует hERG калиевый канал, приводящий к длительному QT интервал. Теоретически это может увеличить риск вентрикулярная тахикардия, хотя это не кажется клинически значимым.[2]
Препарат также блокирует предсердные натриевые каналы.[2]
Фармакокинетика и фармакогеномика
После настаивания вещество быстро распределяется в организме. в сыворотка крови, 53–56% находятся в свободном обращении и не связаны белки плазмы. У людей с нормальной функцией CYP2D6 основной путь деградации — это О-деметилирование через этот фермент. В 2D6 плохие метаболизаторы, вернакалант в основном инактивируется глюкуронизация и выводится почками. Период полувыведения составляет три часа у 2D6 экстенсивных (нормальных) метаболизаторов и 5,5 часа у слабых метаболизаторов. Различия между бедными и экстенсивными метаболизаторами в отношении пиковых концентраций, AUC и период полураспада не имеют клинического значения.[1][3]
Вернакалант не угнетает ферменты. CYP3A4, CYP1A2, CYP2C9, CYP2C19, CYP2E1, ни белок-переносчик P-gp.[1]
Химия
В молекуле три асимметричный углерод атомов, учитывая 23 = 8 стереомеры. В транс известно, что стереомеры фармакологически активны, но только RRR-форма содержится в продаваемой рецептуре. В SRR-форма (с гидроксильная группа в S конфигурация) является второстепенным метаболитом, который образуется в организме человека, в основном, в плохих метаболизаторах.[3]
Настой содержит вернакалант гидрохлорид, который хорошо растворим в воде.[3]
История
Вернакалант изначально был разработан Кардиом Фарма, а внутривенный препарат был куплен для доработки Merck в апреле 2009 г.[4] В сентябре 2012 года Merck расторгла свои соглашения с Cardiome и, следовательно, вернула все права на препарат обратно компании Cardiome, которая с 2018 года известна как Корревио Фарма.
11 декабря 2007 г. Консультативный комитет США по сердечно-сосудистым и почечным препаратам Управление по контролю за продуктами и лекарствами (FDA) проголосовало за рекомендацию одобрения вернакаланта,[5] но в августе 2008 года FDA решило, что для утверждения необходима дополнительная информация.[4] В Европе препарат был одобрен под торговой маркой Brinavess 1 сентября 2010 года.[6]
Пероральный препарат прошел фазу II. клинические испытания с 2005 по 2008 гг.[7][8]
10 декабря 2019 г. Заявка на новый препарат для вернакаланта обсуждался Консультативным комитетом по сердечно-сосудистым и почечным препаратам.[9] Консультативный комитет проголосовал за то, чтобы не рекомендовать утверждение.[10]
Смотрите также
- Алмокалант
Рекомендации
- ^ а б c d е ж грамм час «Brinavess: EPAR — Информация о продукте» (PDF). Европейское агентство по лекарствам. 19 декабря 2019.
- ^ а б Мики Финнин, Вернакалант: новое средство для прекращения фибрилляции предсердий: фармакология, Medscape сегодня, получено 12 октября 2010
- ^ а б c «Brinavess: EPAR — Отчет об общественной оценке» (PDF). Европейское агентство по лекарствам. 25 июня 2010 г.
- ^ а б «Merck и Cardiome Pharma подписывают лицензионное соглашение на Vernakalant, исследуемый препарат для лечения фибрилляции предсердий». FierceBiotech. 9 апреля 2009 г.. Получено 12 октября 2010.
- ^ «Консультативный комитет FDA рекомендует одобрить Kynapid для лечения острой фибрилляции предсердий». Drugs.com. Получено 15 марта 2008.
- ^ «Brinavess (вернакалант) для инфузий, одобренный в Европейском союзе для быстрого лечения недавно развившейся фибрилляции предсердий» (Пресс-релиз). Merck & Co., Inc., 1 сентября 2010 г. Архивировано с оригинал 28 сентября 2010 г.. Получено 28 сентября 2010.
- ^ Номер клинического исследования NCT00267930 за «Исследование RSD1235-SR для профилактики фибрилляции предсердий / рецидива трепетания предсердий» в ClinicalTrials.gov
- ^ Номер клинического исследования NCT00526136 для «Vernakalant (Oral) Prevention of the Atrial Fibrillation Recurrent Fibrillation Study Post-Conversion Study» в ClinicalTrials.gov
- ^ «Объявление о заседании Консультативного комитета по сердечно-сосудистым и почечным препаратам от 10 декабря 2019 г.». FDA.gov. Получено 9 декабря 2019.
- ^ «Группа FDA опровергает кардиоверсию препарата Afib из соображений безопасности». MedPage сегодня. Получено 11 декабря 2019.
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.АртритАртрозБоль в суставахБоль в суставах и мышцахВоспаление суставовДля суставов и связокНа лучезапястный сустав
Содержание статьи
- Армавискон: уколы для суставов
- Ферматрон или Армавискон: что лучше?
- Что лучше: Флексотрон или Армавискон
- Армавискон или РусВиск: что лучше?
- Краткое содержание
- Задайте вопрос эксперту по теме статьи
Остеоартроз — большая группа заболеваний суставов со сходными проявлениями. В основе лежит поражение всех компонентов сустава, в первую очередь — хряща. Число пациентов с артрозами увеличивается с возрастом: после 50 лет частота болезни составляет 27%, после 60 лет — 97%, а к 80 годам симптомы остеоартроза диагностируются у каждого человека.
Подход к лечению остеоартрозов должен быть комплексным и включать нефармакологические (лечебная физкультура, физиотерапия), медикаментозные и хирургические методы. В Федеральные клинические рекомендации по диагностике и лечению остеоартроза включены в числе других препараты на основе гиалуроновой кислоты. Их относят к симптоматическим лекарственным средствам медленного действия.
Провизор Наталья Асанова на примере Армавискона разбирает принцип «работы» таких препаратов и сравнивает его с аналогами.
Армавискон: уколы для суставов
Армавискон — протез синовиальной жидкости на основе гиалуроновой кислоты. Это отечественное медицинское изделие в преднаполненных шприцах. Средство вводят непосредственно в суставную полость с помощью тонкой иглы. Инъекцию делает врач, имеющий опыт внутрисуставных введений.
Армавискон содержит активное вещество натрия гиалуронат и выпускается в следующих дозировках:
- Армавискон Форте уколы для суставов 2,3% (69 мг/3 мл) — 1 инъекция на курс
- Армавискон Платинум 3% (90 мг/3 мл) — 1 инъекция на курс
- Армавискон Плюс 1,5% (30 мг/2 мл) — до 3 инъекций на курс
- Армавискон Вита 1% (20 мг/2 мл) — до 5 инъекций на курс
- Комбинированные формы:
- Армавискон Хондро содержит 60 мг/3 мл натрия гиалуроната + 90 мг/3 мг хондроитина сульфата — 1 инъекция на курс
- Армавискон МН содержит 40 мг/2 мл натрия гиалуроната + маннитол 10 мг/2 мл — 2 инъекции на курс
Для чего же нужна гиалуроновая кислота в суставе? При остеоартрозе самой уязвимой структурой является суставной хрящ. Под влиянием дегенеративно-дистрофические изменений он истончается, а синовиальная жидкость теряет свои эластичные свойства.
Гиалуроновая кислота — естественная основа синовиальной жидкости. Она уменьшает нагрузку на хрящ, обеспечивает амортизацию и снижает трение суставных поверхностей. За счет активации хондроцитов (клеток, вырабатывающих компоненты хрящевой ткани) и синовиоцитов (вырабатывающих компоненты синовиальной жидкости) гиалуроновая кислота обеспечивает восстановление и питание хряща.
Протезы синовиальной жидкости берут на себя нагрузку и компенсируют недостаток собственной синовиальной жидкости. Как результат — купируют боль и возвращают подвижность суставам.
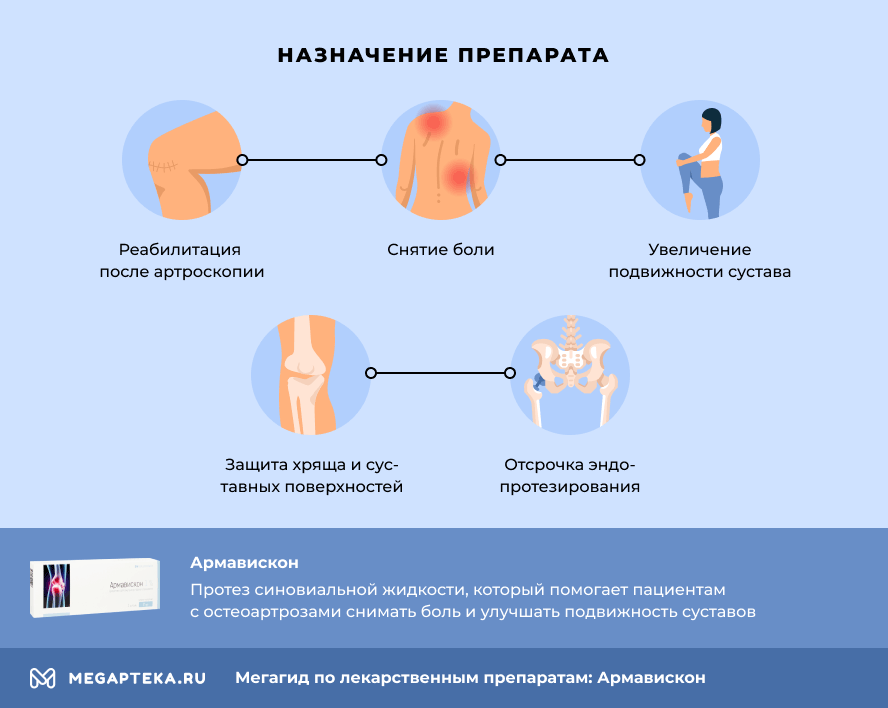
Армавискон с разной концентрацией гиалуроната натрия назначают пациентам с остеоартрозами:
- для защиты хряща и суставных поверхностей
- для увеличения подвижности сустава
- для снятия боли
- для лечения пациентов при повышенных физических нагрузках и регулярной нагрузке на пораженный сустав.
- для реабилитации после артроскопии
- для отсрочки эндопротезирования
Ферматрон или Армавискон: что лучше?
Ферматрон — заменитель суставной жидкости на основе натрия гиалуроната, как и Армавискон. Он также купирует болевой синдром и восстанавливает подвижность в суставах при дегенеративных и травматических изменениях. Выпускается в трех дозировках:
- Ферматрон 1% гиалуронат натрия (20 мг/2 мл) — 5 инъекций на курс лечения одна инъекция в неделю
- Ферматрон плюс 1,5% гиалуронат натрия (30 мг/2 мл) — 3 инъекции на курс лечения
- Ферматрон С 2,3% гиалуронат натрия (69 мг/3 мл) — 1 инъекция на курс лечения
У Армавискона (Гротекс, Россия) больше лекарственных форм, чем у Ферматрона (Хайэлтек Лтд, Великобритания). Ассортимент включает шприцы с различной концентрацией натрия гиалуроната от 1% до 3%, что дает возможности врачам подобрать медизделие индивидуально, в зависимости от физической активности, возраста, веса. Кроме этого, у Армавискона есть комбинированные формы с маннитолом и хондроитином с более высокими защитными свойствами.
Нельзя ответить однозначно на вопрос: «Армавискон или Ферматрон — что лучше?»
Ферматрон — один из первых протезов синовиальной жидкости на российском рынке, Армавискон появился позднее. Показания у них одинаковые. При соблюдении выписанной концентрации натрия гиалуроната их можно заменять друг на друга.
Что лучше: Флексотрон или Армавискон
Флексотрон, как и Армавискон, — препарат с гиалуронатом натрия в составе. Продукты Флексотрон изготовлены из японской и французской субстанции. Армавискон произведен на основе гиалуроновой кислоты производства Франции.
Линейка имплантатов Флексотрон содержит шесть продуктов с разной концентрацией активного вещества и особенностями состава.
Например, Флексотрон Ультра — первый на российском рынке препарат с максимальным содержанием гиалуроната натрия в одном шприце (120 мг) для однократной инъекции в коленный сустав. Аналогов у него пока нет. А Флексотрон Кросс — первый в России имплантат перекрестно-сшитого гиалуроната натрия для однократной инъекции с запатентованной технологией CHAP.
Каждый продукт имеет преимущества и показания для определенных состояний и пациентов. Выбор оптимального препарата должен делать врач.
Армавискон или РусВиск: что лучше?
РусВиск — еще один эндопротез российского производства с натрием гиалуронатом . Его назначают для временной замены синовиальной жидкости или в дополнение к ней. Он представлен в одной концентрации 1,6% в шприцах объемом 1, 2, 3 и 5 мл. Внутрисуставное введение препарата восстанавливает свойства синовиальной жидкости, уменьшает боль и улучшает подвижность сустава.
Содержание натрия гиалуроната в шприцах РусВиска не соответствует количеству в Армависконе: 16, 32, 48 и 80 мг против 20, 30, 69 и 90 мг. Поэтому выбор препарата будет определяться лечащим врачом с учетом возраста пациента, его физической активности, стадии заболевания, сопутствующих болезней. Протезы синовиальной жидкости подбирают с различной молекулярной массой, структурой и концентрацией. Количество инъекций на курс лечения тоже зависит от этого.
Краткое содержание
- Армавискон — это протез синовиальной жидкости, который помогает пациентам с остеоартрозами снимать боль, улучшать подвижность суставов и защищать хрящевую ткань. Действующее вещество — гиалуронат натрия разной концентрации. На рынке препарат представлен в шести лекарственных формах.
- У Армавискона есть аналоги на основе натрия гиалуроната: Ферматрон, Флексотрон, Русвиск. Их объединяют показания к применению при артрозах синовиальных суставов. Врач подбирает эндопротез индивидуально, учитывая молекулярную массу, структуру и концентрации гиалуроновой кислоты. По замене одного препарата на другой следует проконсультироваться у вашего доктора.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же вы можете поделиться своим опытом с другими читателями Мегасоветов.
Выпускающий редактор
Эксперт-провизор
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда