
Приготовление буферных растворов — распространенная процедура в химических и биохимических лабораториях. Буферный раствор — это смесь слабой кислоты и сопряженного с ней основания или слабого основания и сопряженной с ним кислоты. Буферные растворы позволяют поддерживать стабильный уровень pH другого раствора, смешанного с буферным. Если в раствор попадает небольшое количество другой кислоты или щелочи или они образуются в ходе химической реакции, буферный раствор не допустит изменения значения pH всего раствора. Поэтому буферы очень полезны в разных задачах, где требуется поддержание стабильного уровня pH. Другие названия буферных растворов — также pH-буферы, водород-ионные буферы или просто буферы.
Например, в крови человека содержатся естественные буферы для поддержания рН в диапазоне от 7,35 до 7,45 — именно при таком уровне могут нормально действовать энзимы. Поскольку активность энзимов зависит от pH, при проведении биохимических анализов необходимо поддержание этого параметра на постоянном уровне. Буферные растворы применяются в шампунях для предотвращения раздражения кожи, в детских лосьонах для противодействия росту бактерий, а также в растворах для контактных линз, чтобы уровень pH жидкости оставался совместимым с уровнем рН глаз.
Приготовление буферного раствора состоит из нескольких этапов: взвешивание компонентов, растворение компонентов, корректировка pH и дополнение до заданного объема. Поскольку итоговое значение pH в буфере зависит от соотношения кислоты и основания, чрезвычайно важно взвешивать компоненты с высокой точностью. Все используемое оборудование (весы, пипетки и рН-метр) должно быть правильно откалибровано и иметь достаточную точность.
Видео: приготовление буферного раствора — простота, удобство и точность
Для приготовления буферного раствора нужны время и особая тщательность, иначе раствор не будет действовать так, как требуется. Если качество продукции или биохимических анализов зависит от качества буферных растворов, ошибки при приготовлении буферов недопустимы.
Посмотрите видео и узнайте, как можно сэкономить время и силы, если готовить буферные растворы с помощью технических весов и рН-метров МЕТТЛЕР ТОЛЕДО.
Перейдите в один из следующих разделов, чтобы узнать больше:
- Как готовить буферные растворы? Стандартная процедура.
- Секреты работы с буферными растворами
- Как действуют буферные растворы?
- Разновидности буферных растворов
- На что следует обращать внимание при приготовлении буферного раствора
- Преимущества универсальных буферных растворов
- Дополнительные советы по приготовлению и использованию буферных растворов
- Запросить консультацию по процедурам приготовления буферных растворов
- Сложности при приготовлении буферных растворов
- Специальное решение МЕТТЛЕР ТОЛЕДО для точного и удобного приготовления буферного раствора
- Руководство по эффективному взвешиванию
- Приготовление буферных растворов: оптимизированный рабочий процесс с комплексным управлением данными
- Как обеспечить правильную калибровку pH-метра
- Часто задаваемые вопросы о приготовлении буферных растворов
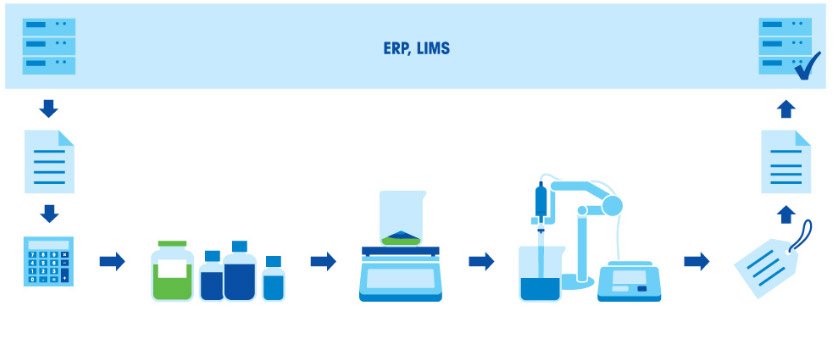
Как готовить буферные растворы? Стандартная процедура
Приготовление буферного раствора состоит из нескольких этапов: расчет концентрации и количества компонентов в соответствии с назначением и нужным объемом раствора; взвешивание компонентов; растворение компонентов; корректировка pH; дополнение до заданного объема; маркировка и документирование; использование раствора или его сохранение для применения в будущем.
- Выберите рецептуру из базы данных.
- Рассчитайте количество компонентов, указанных в рецептуре, в соответствии с требуемым объемом буферного раствора.
- Взвесьте компоненты и поместите их в сосуд.
- Растворите компоненты в подходящем растворителе (обычно в воде).
- С помощью рН-метра проверьте и скорректируйте значение pH.
- Долейте раствор до необходимого объема.
- Переместите раствор в бутыль для хранения и нанесите на нее соответствующую маркировку.
- Задокументируйте результаты.

Нужна помощь?
Буферные растворы чрезвычайно важны для решения многих практических задач. Однако приготовление буферного раствора требует много времени и сил и должно производиться тщательно, чтобы избежать ошибок. Если вам нужна помощь в приготовлении буферных растворов или при подборе весов с требуемым уровнем точности, проконсультируйтесь с экспертами МЕТТЛЕР ТОЛЕДО. В случае сомнений обратитесь к специалистам.

Сложности при приготовлении буферных растворов
Хотя простейший буферный раствор состоит только из кислоты, основания и воды, лаборантам часто приходится готовить по несколько буферных растворов в день. Обычно буферы состоят из 2–5 компонентов, но иногда их количество достигает 20. В обычной лаборатории может быть более 20 рецептур, рассчитанных на приготовление одного литра буферного раствора.
Расчеты буферных растворов
Если в базе данных содержится несколько десятков рецептур для буферных растворов, лаборанту нужно сначала удостовериться, что рецептура выбрана правильно. Если нужный объем буферного раствора отличается от одного литра, необходимо пересчитать количество всех компонентов и записать в журнал новые значения. Ошибки в вычислениях или при записи новых значений могут привести к неправильному уровню pH в буферном растворе. При ручной системе записи данных риск ошибок выше.
Взвешивание и запись результатов взвешивания
При взвешивании компонентов буферного раствора необходимо строго следить за соответствием типа и количества компонентов. Фактическую массу всех компонентов нужно записывать в журнал. Если запись результатов выполняется вручную или вводом значений в компьютер, необходимо внимательно следить за отсутствием ошибок.
Возможно, придется использовать несколько весов в зависимости от требуемой массы компонентов буферного раствора и минимальной массы, с которой могут работать весы. Это усложняет процесс и снижает эффективность.
Правильная работа с рН-метрами
Проверка уровня pH буферного раствора чрезвычайно важна. Но если рН-метр не откалиброван и не поддерживается в надлежащем состоянии, измерения рН могут быть неточными. Использование буферного раствора с неправильным pH может серьезно повлиять на последующий анализ или качество продукта.
Документация
Полученный буферный раствор должен быть правильно промаркирован. На этикетке нужно указать все данные, необходимые для предотвращения ошибок. Важно знать срок годности, чтобы буферный раствор сохранял эффективность. Все данные, связанные с приготовлением буферного раствора, нужно внести в журнал. Эта информация должна храниться для справки и обеспечения прослеживаемости.

Специальное решение МЕТТЛЕР ТОЛЕДО для точного и удобного приготовления буферного раствора
Технические весы МЕТТЛЕР ТОЛЕДО XSR упрощают приготовление буферных растворов и значительно снижают нагрузку на лаборантов.
Хранение рецептур
Непосредственно на весах можно хранить до 50 рецептур буферных растворов в виде методов взвешивания. Сохранив на весах наиболее часто используемые рецептуры буферных растворов, можно быстро найти нужный метод и начать работу. Весы выдают пошаговые инструкции, поэтому лаборантам легко следить за тем, на каком этапе приготовления буферного раствора они находятся.
Автоматические расчеты и подсказки по взвешиванию
При запуске метода вводится требуемый объем буферного раствора, и массы компонентов рассчитываются автоматически. В ходе взвешивания компонентов на индикаторе SmartTrac графически отображается соответствие фактической массы целевому значению. Цветная полоска становится зеленой, как только масса добавляемого компонента войдет в заданный диапазон допусков. Это позволяет специалистам быстрее и точнее дозировать компоненты.
Эффективные процессы и автоматическая регистрация данных
После добавления каждого компонента весы регистрируют фактический результат взвешивания, а затем выполняют автоматическое тарирование. Записывать результаты вручную не нужно, поэтому эффективность работы повышается. Весы можно настроить на автоматическую печать результатов взвешивания после добавления всех компонентов.
Удобное измерение pH
pH-метры SevenExcellence МЕТТЛЕР ТОЛЕДО — лучший выбор для точного измерения pH. В этих удобных приборах с сенсорным управлением предусмотрена возможность прямого измерения одним нажатием кнопки и реализована технология цифрового управления датчиками (ISM).
Точность измерения рН определяется качеством буферных растворов, используемых для калибровки. МЕТТЛЕР ТОЛЕДО предлагает большой выбор калибровочных буферных растворов высокого качества для самых разных задач.

Guide: Biological Buffer Preparation
Discover how you can make your buffer preparation process easy and reliable.
Download the guide and get useful tips and hints to help improve the productivity of your preparation process, ensure quality standards and traceability for buffer solutions.
- Step-by-step SOP user guidance and accessible buffer recipes directly on the balance screen improves workflows
- Accurate weighing in compounds is vital for the quality of buffer solutions
- Exact and reliable pH measurement is important for the correct preparation of buffers
- Using and operating pipettes the correct way helps to ensure that pH buffer is properly adjusted
- Automatic calculation, labeling and reporting ensure safe data transfer and data traceability

Приготовление буферных растворов: оптимизированный рабочий процесс с комплексным управлением данными
Технические весы МЕТТЛЕР ТОЛЕДО Excellence (XPR и XSR) и pH-метры SevenExcellence можно подключить к фирменному лабораторному ПО LabX и создать полностью оптимизированную систему, обладающую рядом важных преимуществ:
- Автоматические расчеты и документирование
- Все результаты сохраняются в защищенной базе данных.
- Полная прослеживаемость
- Централизованное управление задачами, пользователями и приборами.
Соответствие требованиям части 11 раздела 21 CFR (Свода федеральных постановлений США)
LabX обеспечивает полное управление данными, практически исключая их ручную регистрацию. В автоматическом режиме можно даже печатать этикетки с подробной информацией. Благодаря централизованной базе данных все подключенные пользователи и приборы имеют доступ к одним и тем же сохраненным СОП для приготовления буферных растворов. Таким образом, все лаборанты будут выполнять приготовление буферных растворов с одними и теми же настройками и параметрами. Все результаты и метаданные процесса автоматически сохраняются в защищенной базе данных, что обеспечивает полную прослеживаемость.

Как обеспечить правильную калибровку pH-метра
Для точной калибровки рН-метра нужны качественные калибровочные буферные растворы с известным уровнем рН. МЕТТЛЕР ТОЛЕДО предлагает ряд качественных буферных растворов, в том числе максимально точные растворы, соответствующие требованиям NIST/DIN.
Буферные растворы поставляются с сертификатами испытаний, которые помогут обеспечить соответствие нормативным требованиям и прослеживаемость. В ассортименте МЕТТЛЕР ТОЛЕДО найдутся буферные растворы для любых задач — как технические буферы, так и растворы, сертифицированные аккредитованными организациями.
Часто задаваемые вопросы о приготовлении буферных растворов
Выберите вопрос:
- Что такое анализатор влажности?
- Как работает анализатор влажности?
- Какой анализатор влажности лучше всего подойдет для моих задач?
- Что необходимо учитывать при выборе анализатора влажности?
- Почему при выборе анализатора влажности важно учитывать тип образца?
1. Как повысить эффективность взвешивания при приготовлении буферных растворов?
Пользователи могут сохранять собственные методы взвешивания на весах МЕТТЛЕР ТОЛЕДО XPR/XSR. Для приготовления буферных растворов подходит метод «Простое взвешивание по рецептурам с шаблоном». На весах в виде рецептуры хранятся данные о всех компонентах раствора с заданной массой и интервалом допуска. После запуска метода весы будут выдавать указания по каждому этапу процедуры. Не нужно постоянно сверяться с рецептурой, а этапы процедуры невозможно перепутать. Результаты взвешивания сохраняются автоматически и в конце могут быть распечатаны. Можно сэкономить время, избавившись от необходимости записывать все результаты взвешивания вручную.
2. Какие весы лучше всего подходят для приготовления буферных растворов?
Выбор весов зависит от индивидуальных требований. Нужно знать минимальную и максимальную массу взвешиваемых компонентов, а также требуемую точность взвешивания (допуски или допустимые погрешности). МЕТТЛЕР ТОЛЕДО предлагает бесплатную услугу по подбору весов с учетом специфики применения. Бесплатную рекомендацию по весам можно получить у местного представителя МЕТТЛЕР ТОЛЕДО. В рамках этой же услуги можно определить, соответствуют ли требованиям имеющиеся весы.
- GWP Recommendation
3. При приготовлении буферного раствора нужно записывать очень много данных. Как избежать ошибок? Нужно найти безошибочное решение.
Прежде всего подключите к весам сканер штрихкодов. Это позволит в электронном виде регистрировать идентификаторы образцов, номера партий, номера заказов и т. д. Во-вторых, подключите к весам принтер. В конце процедуры взвешивания принтеры МЕТТЛЕР ТОЛЕДО P-5x могут автоматически распечатывать результаты, метаданные, а также дату и время. Другой вариант — подключить весы к лабораторному программному обеспечению LabX, которое обеспечивает комплексное управление данными, включая создание настраиваемых отчетов, которые можно отправлять прямо в системы LIMS или ERP.
4. Как обеспечить надежность при измерении pH буферного раствора?
Показания рН-метра будут точными, если прибор регулярно проходит калибровку и проверку. Ознакомьтесь с руководством МЕТТЛЕР ТОЛЕДО и решениями для калибровки рН-метров. Посмотрите видео «Калибровка pH-метров — удобное руководство».
5. Что делать, если компонент был добавлен в большем объеме, чем нужно?
Если вы случайно добавили слишком большое количество какого-то компонента, необязательно выбрасывать всю смесь. Можно добавить к ней дополнительное количество других компонентов. Но при ручном расчете объемов это может быть непросто, и риск ошибок высок. Не исключено также, что потребуется добавить очень небольшое количество вещества, и имеющиеся весы не подойдут для его взвешивания. Могут потребоваться вторые весы с более высокой точностью и меньшей минимальной массой. Если весы подключены к LabX, то ПО сможет выполнить все необходимые перерасчеты и проследить за ходом процедуры.
Буферные растворы (ОФС.1.3.0003.15)
Государственная фармакопея 13 издание (ГФ XIII)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
ОФС.1.3.0003.15 Буферные растворы
Взамен ГФ XII, ч.1, ОФС 42-0072-07
Успешное выполнение многих фармакопейных испытаний и методик количественного и качественного анализа требует регулирования или поддержания на определённом уровне величины рН с помощью буферных растворов.
Буферные растворы – растворы с определённой концентрацией водородных ионов (pH), содержащие сопряжённую кислотно-основную пару, обеспечивающую устойчивость величины их водородного показателя при незначительном изменении концентрации, либо при добавлении небольшого количества кислоты или основания.
Забуференные растворы ‒ это системы, в которых конкретный ион находится в равновесии с веществами, способными связывать или высвобождать этот ион. Забуференные растворы способны сохранять активность определенного иона при добавлении веществ, которые, как ожидается, могут изменять активность этого иона.
В фармакопейном анализе применяют кислотные буферные системы (раствор слабой кислоты и ее соли) и основные буферные системы (раствор слабого основания и его соли). рН таких смесей мало меняется при разбавлении в довольно широких пределах (1:100), а также при добавлении небольших количеств сильных кислот или оснований.
Буферный раствор характеризуется значением создаваемого рН и буферной емкостью. Буферная емкость системы определяется количеством моль кислоты или основания (в грамм-эквивалентах на 1 л), добавление которых изменяет рН 1 л (дм3) буферного раствора на 1 единицу рН. Емкость буферного раствора регулируется концентрацией буферных веществ.
Буферные растворы используются для установления и поддержания активности иона в узком диапазоне рН.
Буферные растворы используются в основном:
- а) для калибровки рН-метров;
- б) в аналитических методиках;
- в) для достижения изотоничности при приготовлении жидких лекарственных форм;
- г) для поддержания стабильности дозированных лекарственных форм.
Компоненты буферной системы для целей химического анализа должны сочетаться с определяемым веществом и используемыми реактивами. Буферные и забуференные растворы готовят на воде очищенной. Также можно использовать воду дистиллированную и воду для хроматографии. Буферные и забуференные растворы после приготовления следует тщательно перемешать.
Забуференный ацетоновый раствор
8,15 г натрия ацетата и 42,0 г натрия хлорида растворяют в воде, прибавляют 68,0 мл 0,1 М раствора хлористоводородной кислоты, 150 мл ацетона и доводят объём раствора водой до 500,0 мл.
Буферный раствор рН 2,0
6,57 г калия хлорида растворяют в воде, прибавляют 119,0 мл 0,1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 2,0
8,95 г динатрия гидрофосфата и 3,40 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл. Доводят рН до 2,0 потенциометрически с помощью фосфорной кислоты концентрированной.
Сульфатный буферный раствор рН 2,0
132,1 г аммония сульфата растворяют в воде, доводят объём раствора водой до 500,0 мл (раствор I).
Осторожно при постоянном охлаждении и перемешивании прибавляют 14 мл серной кислоты концентрированной к 400,0 мл воды; охлаждают и доводят объём раствора водой до 500,0 мл (раствор II).
Смешивают равные объёмы растворов I и II; если необходимо, доводят рН до 2,0 потенциометрически раствором I или II.
Буферный раствор рН 2,5
100,0 г калия дигидрофосфата растворяют в 800 мл воды, доводят рН до 2,5 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 2,5 (1)
4,9 г фосфорной кислоты разведённой 10 % смешивают с 250 мл воды, доводят рН до 2,5 потенциометрически с помощью раствора натрия гидроксида разведённого 8,5 % и доводят объём раствора водой до 500,0 мл.
Буферный раствор рН 3,0
21,0 г лимонной кислоты растворяют в 200,0 мл 1 М раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
40,3 мл полученного раствора доводят 0,1 М раствором хлористоводородной кислоты до 100,0 мл.
0,25 М цитратный буферный раствор рН 3,0
4,8 г лимонной кислоты растворяют в 80,0 мл воды. Доводят рН до 3,0 потенциометрически с помощью 1 М раствора натрия гидроксида и доводят объём раствора водой до 100,0 мл.
0,1 М фосфатный буферный раствор рН 3,0
12,0 г натрия дигидрофосфата безводного растворяют в воде. Доводят рН до 3,0 потенциометрически с помощью фосфорной кислоты разведённой 10 % и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 3,0
0,7 мл фосфорной кислоты концентрированной смешивают с 100 мл воды и доводят объём раствора водой до 900,0 мл. Доводят рН до 3,0 с помощью раствора натрия гидроксида концентрированного и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 3,0 (1)
3,40 г калия дигидрофосфата растворяют в 900 мл воды. Доводят рН до 3,0 потенциометрически с помощью фосфорной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 3,2
900,0 мл 4 г/л раствора натрия дигидрофосфата смешивают с 100 мл 2,5 г/л раствора фосфорной кислоты концентрированной. Если необходимо, доводят рН до 3,2 потенциометрически раствором натрия дигидрофосфата или фосфорной кислоты концентрированной.
Фосфатный буферный раствор рН 3,2 (1)
Доводят рН до 3,2 потенциометрически для 35,8 г/л раствора динатрия гидрофосфата c помощью фосфорной кислоты разведённой 10 %.
100,0 мл полученного раствор доводят водой до объема 2000,0 мл.
Буферный раствор рН 3,5
25,0 г аммония ацетата растворяют в 25,0 мл воды, прибавляют 38,0 мл 25 % хлористоводородной кислоты. Если необходимо, доводят рН до 3,5 потенциометрически с помощью хлористоводородной кислоты разведённой 7,3 % или 10% раствора аммиака и доводят объём раствора водой до 100,0 мл.
Фосфатный буферный раствор рН 3,5
68,0 г калия дигидрофосфата растворяют в воде, доводят рН до 3,5 потенциометрически с помощью фосфорной кислоты концентрированной. Доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 3,6
250,0 мл 0,2 М раствора калия гидрофталата смешивают с 11,94 мл 0,2 М рас-твора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 3,7
15,0 мл уксусной кислоты разведенной 30 % смешивают с 60,0 мл спирта 96 % и 20,0 мл воды. Доводят рН до 3,7 потенциометрически с помощью раствора аммиака и доводят объём раствора водой до 100,0 мл.
Забуференный раствор меди сульфата рН 4,0
0,25 г меди (II) сульфата и 4,5 г аммония ацетата растворяют в уксусной кислоте разведённой 12 % и доводят объём раствора тем же растворителем до 100,0 мл.
Ацетатный буферный раствор рН 4,4
136,0 г натрия ацетата и 77,0 г аммония ацетата растворяют в воде и доводят объём раствора водой до 1000,0 мл; прибавляют 250,0 мл уксусной кислоты ледяной и перемешивают.
Фталатный буферный раствор рН 4,4
2,042 г калия гидрофталата растворяют в 50,0 мл воды, прибавляют 7,5 мл
0,2 М раствора натрия гидроксида и доводят водой до объёма 200,0 мл.
0,05 М фосфатный буферный раствор рН 4,5
6,80 г калия дигидрофосфата растворяют в 1000,0 мл воды.
Ацетатный буферный раствор рН 4,5
77,1 г аммония ацетата растворяют в воде, прибавляют 70,0 мл уксусной кислоты ледяной и доводят объём раствора водой до 1000,0 мл.
Натрия ацетатный буферный раствор рН 4,5
63,0 г натрия ацетата безводного растворяют в воде, прибавляют 90,0 мл уксусной кислоты разведенной 30 %. Доводят рН до 4,5 потенциометрически уксусной кислотой разведённой 30% и доводят объём раствора водой до 1000,0 мл.
Ацетатный буферный раствор рН 4,6
5,4 г натрия ацетата растворяют в 50,0 мл воды, прибавляют 2,4 г уксусной кислоты ледяной и доводят объём раствора водой до 100,0 мл; если необходимо, доводят рН до 4,6 потенциометрически уксусной кислотой ледяной.
Сукцинатный буферный раствор рН 4,6
11,8 г янтарной кислоты растворяют в смеси 600,0 мл воды и 82,0 мл 1 М раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Ацетатный буферный раствор рН 4,7
136,1 г натрия ацетата растворяют в 500,0 мл воды. 250,0 мл полученного раствора смешивают с 250,0 мл уксусной кислоты разведённой 12 %. Встряхивают дважды со свежеприготовленным отфильтрованным 0,1 г/л раствором дитизона в хлороформе. Встряхивают с углерода тетрахлоридом до обесцвечивания экстракта. Водный слой фильтруют для удаления следов углерода тетрахлорида.
Ацетатный буферный раствор рН 5,0
К 120,0 мл 6,0 г/л раствора уксусной кислоты ледяной прибавляют 100,0 мл 0,1 М раствора калия гидроксида и 250,0 мл воды, перемешивают. Доводят рН до 5,0 потенциометрически с помощью 6 г/л раствора уксусной кислоты ледяной или 0,1 М раствора калия гидроксида и доводят объём раствора водой до 1000,0 мл.
Цитратный буферный раствор рН 5,0
20,1 г лимонной кислоты и 8,0 г натрия гидроксида растворяют в воде и доводят объём раствора водой до 1000,0 мл. Доводят рН до 5,0 потенциометрически с помощью хлористоводородной кислоты разведённой 7,3 %.
Фосфатный буферный раствор рН 5,0
2,72 г калия дигидрофосфата растворяют в 800,0 мл воды. Доводят рН до 5,0 потенциометрически с помощью 1 М раствора калия гидроксида и доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 5,2
1,02 г калия гидрофталата растворяют в 30,0 мл 0,1 М раствора натрия гидроксида и доводят объём раствора водой до 100,0 мл.
0,067 М фосфатный буферный раствор рН 5,4
Смешивают необходимые объёмы 23,99 г/л раствора динатрия гидрофосфата и 9,12 г/л раствора натрия дигидрофосфата моногидрата, чтобы получить рН 5,4. Доводят рН до 5,4 потенциометрически.
Буферный раствор рН 5,5
54,4 г натрия ацетата растворяют в 50,0 мл воды, если необходимо, нагревают до температуры 35 С. После охлаждения полученного раствора к нему медленно приливают 10,0 мл уксусной кислоты безводной, перемешивают и доводят объём раствора водой до 100,0 мл.
Ацетатно-эдетатный буферный раствор рН 5,5
250,0 г аммония ацетата и 15,0 г натрия эдетата растворяют в 400,0 мл воды и прибавляют 125,0 мл уксусной кислоты ледяной.
Фосфатный буферный раствор рН 5,5
Раствор I. 13,61 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Раствор II. 35,81 г динатрия гидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Смешивают 96,4 мл раствора I и 3,6 мл раствора II.
Фосфатно-цитратный буферный раствор рН 5,5
56,85 мл 28,4 г/л раствора динатрия гидрофосфата безводного смешивают с 43,15 мл 21,0 г/л раствора лимонной кислоты.
Фосфатный буферный раствор рН 5,8
1,19 г динатрия гидрофосфата дигидрата и 8,25 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Ацетатный буферный раствор рН 6,0
100,0 г аммония ацетата растворяют в 300,0 мл воды, приливают 4,1 мл уксусной кислоты ледяной. Если необходимо, доводят рН до 6,0 с помощью раствора аммиака или уксусной кислоты разведенной 30 % и доводят объём раствора водой до 500,0 мл.
Диэтиламмония фосфата буферный раствор рН 6,0
68,0 мл фосфорной кислоты концентрированной осторожно разбавляют водой до 500,0 мл. 25,0 мл полученного раствора смешивают с 450,0 мл воды и 6,0 мл диэтиламина. Если необходимо, доводят рН до (6 0,05) потенциометрически с помощью диэтиламина или кислоты фосфорной концентрированной и доводят объём раствора водой до 500,0 мл.
Фосфатный буферный раствор рН 6,0
63,2 мл 71,5 г/л раствора динатрия гидрофосфата смешивают с 36,8 мл 21 г/л раствора лимонной кислоты.
Фосфатный буферный раствор рН 6,0 (1)
6,8 г натрия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл. Доводят рН до 6,0 потенциометрически с помощью раствора натрия гидроксида концентрированного.
Фосфатный буферный раствор рН 6,0 (2)
250,0 мл 0,2 М раствора калия дигидрофосфата смешивают с 28,5 мл 0,2 М раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 6,4
2,5 г динатрия гидрофосфата, 2,5 г натрия дигидрофосфата и 8,2 г натрия хлорида растворяют в 950,0 мл воды. Если необходимо, доводят рН до 6,4 потенциометрически с помощью 1 М раствора натрия гидроксида или 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 6,4 (1)
1,79 г динатрия гидрофосфата, 1,36 г калия дигидрофосфата и 7,02 г натрия хлорида растворяют в воде и доводят объём раствора водой до 1000,0 мл.
0,5 М фталатный буферный раствор рН 6,4
100,0 г калия гидрофталата растворяют в воде и доводят объём раствора водой до 1000,0 мл. Доводят рН до 6,4 потенциометрически с помощью раствора натрия гидроксида концентрированного.
Буферный раствор рН 6,5
60,5 г динатрия гидрофосфата и 46,0 г калия дигидрофосфата растворяют в воде, прибавляют 100,0 мл 0,02 М раствора натрия эдетата, 20 мг ртути (II) хлорида и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 6,5
2,75 г натрия дигидрофосфата и 4,5 г натрия хлорида растворяют в 500 мл воды. Доводят рН до 6,5 потенциометрически с помощью фосфатного буферного раствора рН 8,5.
0,1 М фосфатный буферный раствор рН 6,5
13,80 г натрия дигидрофосфата моногидрата растворяют в 900,0 мл воды. Доводят рН до 6,5 потенциометрически с помощью раствора натрия гидроксида концентрированного и доводят объём раствора водой до 1000,0 мл.
Имидазольный буферный раствор рН 6,5
6,81 г имидазола, 1,23 г магния сульфата и 0,73 г кальция сульфата растворяют в 752 мл 0,1 М раствора хлористоводородной кислоты. Если необходимо, доводят рН до 6,5 потенциометрически 0,1 М раствором хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 6,6
250,0 мл 0,2 М раствора калия дигидрофосфата смешивают с 89,0 мл 0,2 М раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Фосфатный забуференный физиологический раствор рН 6,8
1,0 г калия дигидрофосфата, 2,0 г дикалия гидрофосфата и 8,5 г натрия хлорида растворяют в 900 мл воды. Если необходимо, доводят рН до 6,8 потенциометрически 0,1 М раствором хлористоводородной кислоты или 0,1 М раствором натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 6,8
77,3 мл 71,5 г/л раствора динатрия гидрофосфата смешивают с 22,7 мл 21 г/л раствора лимонной кислоты.
Фосфатный буферный раствор рН 6,8 (1)
51,0 мл 27,2 г/л раствора калия дигидрофосфата смешивают с 49,0 мл 71,6 г/л раствора динатрия гидрофосфата. Если необходимо, доводят рН до 6,8 потенциометрически исходным раствором калия дигидрофосфата или динатрия гидрофосфата.
Хранят при температуре от 2 до 8 ºС.
1 М трис-гидрохлорида буферный раствор рН 6,8
60,6 г трис(гидроксиметил)аминометана растворяют в 400 мл воды, доводят рН до 6,8 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 500,0 мл.
Малеатный буферный раствор рН 7,0
10,0 г натрия хлорида, 6,06 г трис(гидроксиметил)аминометана и 4,90 г малеинового ангидрида растворяют в 900,0 мл воды. Доводят рН до 7,0 потенциометрически с помощью 170 г/л раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Хранят при температуре от 2 до 8 ºС.
Фосфатный буферный раствор рН 7,0
82,4 мл 71,5 г/л раствора динатрия гидрофосфата смешивают с 17,6 мл 21 г/л раствора лимонной кислоты.
Фосфатный буферный раствор рН 7,0 (1)
250,0 мл 0,2 М раствора калия дигидрофосфата смешивают со 148,2 мл 8 г/л раствора натрия гидроксида. Если необходимо, доводят рН до 7,0 потенциометрически исходным раствором калия дигидрофосфата или натрия гидроксида и доводят объём раствора водой до 1000,0мл.
Фосфатный буферный раствор рН 7,0 (2)
50,0 мл 136 г/л раствора калия дигидрофосфата смешивают с 29,5 мл 1 М раствора натрия гидроксида, доводят объём раствора водой до 100,0 мл. Доводят рН до 7,0 потенциометрически исходным раствором калия дигидрофосфата или натрия гидроксида.
Фосфатный буферный раствор рН 7,0 (3)
5,0 г калия дигидрофосфата и 11,0 г дикалия гидрофосфата растворяют в 900,0 мл воды. Доводят рН до 7,0 потенциометрически с помощью фосфорной кислоты разведённой 10 % или раствора натрия гидроксида разведённого 8,5 % и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 7,0 (4)
28,4 г динатрия гидрофосфата безводного и 18,2 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 500,0 мл.
Фосфатный буферный раствор рН 7,0 (5)
28,4 г динатрия гидрофосфата безводного растворяют в 800,0 мл воды. Доводят рН до 7,0 потенциометрически с помощью 30 % раствора фосфорной кислоты и доводят объём раствора водой до 1000,0 мл.
0,025 М фосфатный буферный раствор рН 7,0
1 объём 0,063 М фосфатного буфера рН 7,0 смешивают с 1,5 объёмами воды.
0,03 М фосфатный буферный раствор рН 7,0
5,2 г дикалия гидрофосфата растворяют в 900,0 мл воды. Доводят рН до 7,0 с помощью фосфорной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
0,063 М фосфатный буферный раствор рН 7,0
5,18 г динатрия гидрофосфата безводного и 3,65 г натрия дигидрофосфата моногидрата растворяют в 950,0 мл воды. Доводят рН до 7,0 потенциометрически с помощью фосфорной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
0,067 фосфатный буферный раствор рН 7,0
Раствор I. 0,908 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 100,0 мл.
Раствор II. 2,38 г динатрия гидрофосфата растворяют в воде и доводят объём раствора водой до 100,0 мл.
38,9 мл раствора I смешивают с 61,1 мл раствора II; если необходимо, доводят рН до 7,0 потенциометрически раствором I или II.
0,1 М фосфатный буферный раствор рН 7,0
1,361 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 100,0 мл. Доводят рН до 7,0 потенциометрически с помощью 35 г/л раствора динатрия гидрофосфата
Тетрабутиламмония буферный раствор рН 7,0
6,16 г аммония ацетата растворяют в смеси 15,0 мл 400 г/л раствора тетрабутиламмония гидроксида и 185,0 мл воды. Если необходимо, доводят рН до 7,0 потенциометрически с помощью азотной кислоты концентрированной.
Буферный раствор рН 7,2
250,0 мл 0,2 М раствора калия дигидрофосфата смешивают с 175,0 мл 0,2 М раствора натрия гидроксида. Доводят рН до 7,2 потенциометрически 0,2 М раствором калия дигидрофосфата или 0,2 М раствором натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Фосфатный буферный раствор рН 7,2
87,0 мл 71,5 г/л раствора динатрия гидрофосфата смешивают с 13,0 мл 21 г/л раствора лимонной кислоты.
Забуференный солевой раствор рН 7,2
8,0 г натрия хлорида, 0,2 г калия хлорида, 0,1 г кальция хлорида безводного, 0,1 г магния хлорида, 3,18 г динатрия гидрофосфата и 0,2 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Фосфатно-альбуминовый забуференный физиологический раствор рН 7,2
10,75 г динатрия гидрофосфата, 7,6 г натрия хлорида и 10,0 г альбумина бычьего растворяют в воде и доводят объём раствора водой до 1000,0 мл. Непосредственно перед использованием доводят рН до 7,2 потенциометрически с помощью раствора натрия гидроксида разведённого 8,5 % или фосфорной кислоты разведённой 10 %.
Фосфатно–альбуминовый забуференный физиологический раствор рН 7,2 (1)
10,75 г динатрия гидрофосфата, 7,6 г натрия хлорида, 1,0 г альбумина бычьего растворяют в воде и доводят объём раствора водой до 1000,0 мл. Непосредственно перед использованием доводят рН до 7,2 потенциометрически с помощью раствора натрия гидроксида разведённого 8,5 % или фосфорной кислоты разведённой 10 %.
Имидазольный буферный раствор рН 7,3
3,4 г имидазола и 5,8 г натрия хлорида растворяют в воде, приливают 18,6 мл 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл; если необходимо, доводят рН до 7,3 потенциометрически 1 М раствором хлористоводородной кислоты.
Буферный раствор рН 7,4
0,6 г калия дигидрофосфата, 6,4 г динатрия гидрофосфата и 5,85 г натрия хлорида растворяют в воде, если необходимо, доводят рН до 7,4 потенциометрически 0,1 М раствором хлористоводородной кислоты или 0,1 М раствором натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Барбитал-буферный раствор рН 7,4
50,0 мл раствора, содержащего 19,44 г/л натрия ацетата и 29,46 г/л барбитал-натрия, смешивают с 50,5 мл 0,1 М раствора хлористоводородной кислоты, прибавляют 20,0 мл 85 г/л раствора натрия хлорида и доводят объём раствора водой до 250,0 мл.
Фосфатный буферный раствор рН 7,4
393,4 мл 0,1 М раствора натрия гидроксида смешивают с 250,0 мл 0,2 М раствора калия дигидрофосфата.
Трис(гидроксиметил)аминометана – натрия хлорида буферный раствор рН 7,4
6,08 г трис(гидроксиметил)аминометана и 8,77 г натрия хлорида растворяют в 500 мл воды, прибавляют 10,0 г альбумина бычьего. Доводят рН до 7,4 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Трис — натрия ацетата буферный раствор рН 7,4
6,3 г трис(гидроксиметил)аминометана и 4,9 г натрия ацетата безводного растворяют в 900,0 мл воды. Доводят рН до 7,4 с помощью серной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Трис – натрия ацетата – натрия хлорида буферный раствор рН 7,4
30,0 г трис(гидроксиметил)аминометана, 14,5 г натрия ацетата безводного, 14,6 г натрия хлорида растворяют в 900,0 мл воды и прибавляют 0,50 г альбумина бычьего. Доводят рН до 7,4 потенциометрически с помощью серной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Фосфатный забуференный физиологический раствор рН 7,4
2,38 г динатрия гидрофосфата, 0,19 г калия дигидрофосфата и 8,0 г натрия хлорида растворяют в воде, если необходимо, доводят рН до 7,4 потенциометрически 0,1 М раствором хлористоводородной кислоты или 0,1 М раствором натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Боратный буферный раствор рН 7,5
2,5 г натрия хлорида, 2,85 г натрия тетрабората и 10,5 г борной кислоты растворяют в воде, если необходимо, доводят рН до 7,5 потенциометрически 0,1 М раствором хлористоводородной кислоты или 0,1 М раствором натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Хранят при температуре от 2 до 8 ºС.
Буферный (HEPES) раствор рН 7,5
2,38 г 2-[4-(2-гидроксиэтил)пиперазин-1-ил]этансульфоновой кислоты растворяют в 90 мл воды. Доводят рН до 7,5 потенциометрически с помощью 20 % раствора натрия гидроксида и доводят объём раствора водой до 100,0 мл.
0,2 М фосфатный буферный раствор рН 7,5
27,22 г калия дигидрофосфата растворяют в 930,0 мл воды. Доводят рН до 7,5 потенциометрически с помощью 300 г/л раствора калия гидроксида и доводят объём раствора водой до 1000,0 мл.
0,33 М фосфатный буферный раствор рН 7,5
Раствор I. 119,31 г динатрия гидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Раствор II. 45,36 г калия дигидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
85,0 мл раствора I смешивают с 15,0 мл раствора II; если необходимо, доводят рН до 7,5 потенциометрически раствором I или раствором II.
Трис(гидроксиметил)аминометана буферный раствор рН 7,5
7,27 г трис(гидроксиметил)аминометана и 5,27 г натрия хлорида растворяют в воде. Если необходимо, доводят рН до 7,5 потенциометрически исходным раствором трис(гидроксиметил)аминометана или 0,1 М раствором хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
0,05 М трис – гидрохлорида буферный раствор рН 7,5
6,057 г трис(гидроксиметил)аминометана растворяют в воде. Если необходимо, доводят рН до 7,5 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Натрия цитрата буферный раствор рН 7,8 (0,034 М натрия цитрата и 0,101 М натрия хлорида раствор)
10,0 г натрия цитрата и 5,90 г натрия хлорида растворяют в 900,0 мл воды. Доводят рН до 7,8 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 8,0
50,0 мл 0,2 М раствора калия дигидрофосфата смешивают с 46,8 мл 0,2 М раствора натрия гидроксида и доводят объём раствора водой до 200,0 мл.
Буферный раствор рН 8,0 (1)
20,0 г дикалия гидрофосфата растворяют в 900,0 мл воды. Доводят рН до 8,0 потенциометрически с помощью фосфорной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
0,0015 М боратный буферный раствор рН 8,0
0,572 г натрия тетрабората и 2,94 г кальция хлорида растворяют в 800,0 мл воды. Доводят рН до 8,0 с помощью 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
0,02 М фосфатный буферный раствор рН 8,0
50,0 мл 0,2 М раствора калия дигидрофосфата смешивают с 46,8 мл 0,2 М раствора натрия гидроксида и доводят объём раствора водой до 500,0 мл.
0,1 М фосфатный буферный раствор рН 8,0
0,523 г калия дигидрофосфата и 16,73 г дикалия гидрофосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
1 М фосфатный буферный раствор рН 8,0
136,1 г калия дигидрофосфата растворяют в воде. Доводят рН до 8,0 потенциометрически с помощью 1 М раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Трис – натрия ацетатный буферный раствор рН 8,0
6,3 г трис(гидроксиметил)аминометана и 4,9 г натрия ацетата безводного растворяют в 900,0 мл воды. Доводят рН до 8,0 потенциометрически с помощью серной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
1 М трис – гидрохлоридный буферный раствор рН 8,0
121,1 г трис (гидроксиметил)аминометана и 1,47 г кальция хлорида растворяют в 900,0 мл воды. Доводят рН до 8,0 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 1000,0 мл.
Трис – гидрохлоридный буферный раствор рН 8,0
1,21 г трис (гидроксиметил)аминометана и 29,4 мг кальция хлорида растворяют в воде. Доводят рН до 8,0 потенциометрически с помощью 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 100,0 мл.
Трис (гидроксиметил)аминометана буферный раствор рН 8,1
0,294 г кальция хлорида растворяют в 40,0 мл раствора трис(гидрокси-метил)аминометана 24,22 г/л. Доводят рН до 8,1 потенциометрически с помощью 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 100,0 мл.
Трис – глицина буферный раствор рН 8,3
6,0 г трис(гидроксиметил)аминометана и 28,8 г глицина растворяют в 500,0 мл воды и доводят объём раствора водой до 1000,0 мл. Непосредственно перед использованием 1 объём приготовленного раствора доводят водой до 10 объёмов.
Барбитала буферный раствор рН 8,4
8,142 г барбитал-натрия и 0,287 г натрия ацетата растворяют в воде, добавляют 90,0 мл 0,1 M хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Трис – EDTA – BSA буферный раствор рН 8,4
6,1 г трис(гидроксиметил)аминометана, 2,8 г натрия эдетата, 10,2 г натрия хлорида и 10,0 г альбумина бычьего растворяют в воде. Доводят рН до 8,4 потенциометрически с помощью 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 1000,0 мл.
Трис(гидроксиметил)аминометана – EDTA буферный раствор рН 8,4
5,12 г натрия хлорида, 3,03 г трис(гидроксиметил)аминометана и 1,40 г натрия эдетата растворяют в 250,0 мл воды. Доводят рН до 8,4 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 500,0 мл.
Фосфатный буферный раствор рН 8,5
3,5 г дикалия гидрофосфата и 4,5 г натрия хлорида растворяют в 500,0 мл воды. Доводят рН до 8,5 потенциометрически с помощью смеси равных объёмов фосфорной кислоты разведённой 10 % и воды.
Трис – ацетатный буферный раствор рН 8,5
0,294 г кальция хлорида и 12,11 г трис(гидроксиметил)аминометана растворяют в воде. Доводят рН до 8,5 потенциометрически с помощью уксусной кислоты разведенной 30 % и доводят объём раствора водой до 1000,0 мл.
Трис – боратный буферный раствор с трилоном Б рН 8,6 – 8,8
60,5 г трис(гидроксиметил)аминометана, 6,0 г трилона Б, 19,0 г борной кислоты последовательно растворяют в воде в мерном цилиндре вместимостью 1000,0 мл, доводят объём раствора водой до метки и перемешивают. При необходимости раствор фильтруют через бумажный фильтр. Раствор хранят при температуре 2 – 8 °С не более 3 мес.
1,5 М трис – гидрохлоридный буферный раствор рН 8,8
90,8 г трис(гидроксиметил)аминометана растворяют в 400 мл воды. Доводят рН до 8,8 потенциометрически с помощью хлористоводородной кислоты концентрированной и доводят объём раствора водой до 500,0 мл.
Буферный (фосфатный) раствор рН 9,0
1,74 г калия дигидрофосфата растворяют в 80 мл воды. Доводят рН до 9,0 потенциометрически с помощью 1 М раствора калия гидроксида и доводят объём раствора водой до 100,0 мл.
Буферный раствор рН 9,0
Раствор I. 6,18 г борной кислоты растворяют в 0,1 М растворе калия хлорида и доводят объём раствора тем же растворителем до 1000,0 мл.
Раствор II. 0,1 М раствор натрия гидроксида.
1000,0 мл раствора I смешивают с 420,0 мл раствора II.
Буферный раствор рН 9,0 (1)
6,20 г борной кислоты растворяют в 500,0 мл воды. Доводят рН до 9,0 потенциометрически с помощью 1 М раствора натрия гидроксида (около 41,5 мл) и доводят объём раствора водой до 1000,0 мл.
Аммония хлорида буферный раствор рН 9,5
33,5 г аммония хлорида растворяют в 150,0 мл воды, прибавляют 42,0 мл раствора аммиака концентрированного 25% и доводят объём раствора водой до 250,0 мл. Хранят в полиэтиленовой упаковке.
Аммония хлорида буферный раствор рН 10,0
5,4 г аммония хлорида растворяют в 20,0 мл воды, приливают 35,0 мл раствора аммиака и доводят объём раствора водой до 100,0 мл.
Диэтаноламина буферный раствор рН 10,0
96,4 г диэтаноламина растворяют в воде, доводят объём раствора водой до 400,0 мл, прибавляют 0,5 мл 186 г/л раствора магния хлорида. Доводят рН до 10,0 потенциометрически с помощью 1 М раствора хлористоводородной кислоты и доводят объём раствора водой до 500,0 мл.
0,1 М аммония карбоната буферный раствор рН 10,3
7,91 г аммония карбоната растворяют в 800,0 мл воды. Доводят рН до 10,3 потенциометрически с помощью раствора натрия гидроксида разведённого 8,5 % и доводят объём раствора водой до 1000,0 мл.
Аммония хлорида буферный раствор рН 10,4
70,0 г аммония хлорида растворяют в 200,0 мл воды, прибавляют 330,0 мл раствора аммиака концентрированного 25% и доводят объём раствора водой до 1000,0 мл. Если необходимо, доводят рН до 10,4 потенциометрически с помощью раствора аммиака 17%.
Боратный буферный раствор 10,4
24,64 г борной кислоты растворяют в 900,0 мл воды. Доводят рН до 10,4 потенциометрически с помощью 400 г/л раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Буферный раствор рН 10,9
6,75 г аммония хлорида растворяют в растворе аммиака (см. ОФС «Реактивы. Индикаторы») и доводят объём раствора тем же растворителем до 100,0 мл.
Буфер для регулирования ионной силы
58,5 г натрия хлорида, 57,0 мл уксусной кислоты ледяной, 61,5 г натрия ацетата и 5,0 г циклогексилендинитрилтетрауксусной кислоты растворяют в воде и доводят объём раствора водой до 500,0 мл. Доводят рН до 5,0 – 5,5 с помощью 335 г/л раствора натрия гидроксида и доводят объём раствора водой до 1000,0 мл.
Буфер для регулирования ионной силы (1)
Раствор (а). 210,0 г лимонной кислоты растворяют в 400,0 мл воды. Доводят рН до 7,0 потенциометрически с помощью раствора аммиака концентрированного 25 % и доводят объём раствора водой до 1000,0 мл.
Раствор (б). 132 г аммония фосфата растворяют в воде и доводят объём раствора водой до 1000,0 мл.
Раствор (в). К суспензии 292,0 г (этилендинитрил)тетрауксусной кислоты в 500,0 мл воды прибавляют 200,0 мл раствора аммиака концентрированного 25%. Доводят рН до 6,0-7,0 потенциометрически с помощью раствора аммиака концентрированного 25% и доводят объём раствора водой до 1000,0 мл.
Смешивают равные объёмы растворов (a), (б), (в) и доводят рН до 7,5 с помощью раствора аммиака концентрированного 25 %.
Приготовление буферных растворов
ЗАДАНИЕ
1. Приготовьте
ацетатный буферный раствор по прилагаемой
схеме.
Таблица
2 – Приготовление и определение
рН буферных
растворов
|
Номер буферного |
1 |
2 |
3 |
|
Число
Число |
9,0 1,0 |
5 5 |
1,0 9,0 |
|
рН опытное |
|||
|
рН вычисленное |
Для
каждого буферного раствора определите
значение рН опытным путем и рассчитайте
значения рН по уравнению Гендерсона-Гассельбаха
(при этом отношение концентраций можно
заменить отношением объемов, т.к. в
данном случае нормальные концентрации
кислоты и соли одинаковы). Данные внесите
в таблицу 2.
ФОРМА ОТЧЕТА:
1) укажите цель
работы;
2) заполните таблицы;
3) запишите химические
уравнения соответствующих реакций;
4) по результатам
выполнения каждого задания сделайте
соответствующие выводы, проанализировав,
от каких факторов зависит рН и емкость
буферных растворов.
5.
ХОД ЗАНЯТИЯ:
ТЕОРЕТИЧЕСКИЕ
ОСНОВЫ КИСЛОТНО-ОСНОВНОГО РАВНОВЕСИЯ
Согласно
ионной теории КИСЛОТЫ
– соединения, которые при электролитической
диссоциации в водном растворе образуют
ионы водорода Н+:
НАn
⇄
Н+
+ Аn‾
ОСНОВАНИЯ
– соединения, которые при электролитической
диссоциации в водном растворе образуют
ионы гидроксила ОН‾:
KtОН
⇄
Kt+
+ ОН‾
Рассматривая кислотно-основные равновесия
в водных растворах в дальнейшем будем
считать их приближающимися к идеальным
растворам, т.е. активностью ионов
пренебрегаем (а→ с).
Тогда в соответствии
с законом действующих масс:
(1)
(2)
Вода
проявляет как слабые кислотные, так и
основные свойства (амфолит): Н2О
⇄
Н+
+ ОН¯,
тогда
(3)
При
25оС
К(Н2О)
= 1,8·10ˉ16
(может быть вычислен по электропроводности
воды). Можно считать, что С (Н2О)
– величина постоянная и равна 55,58 моль/л.
Следовательно:
К(Н2О)
· [Н2О]
= 1,8·10ˉ16·55,58
= 10ˉ14
Обозначим
К(Н2О)
[Н2О]
= КW,
где КW
– ионное произведение воды – величина
постоянная при данной температуре не
только для чистой воды, но и для
разбавленных водных растворов любых
веществ.
КW
= [Н+]
· [ОН¯]
= 10ˉ14
(при 25оС) (4)
КW
дает возможность рассчитать концентрацию
Н+
при известной концентрации ОНˉ и
наоборот.
Д
чистой воды (среда нейтральная):
[
= [ОН¯]
== 10ˉ7
моль/л
Если
[Н+]
выше 10‾7
моль/л, а [ОН¯],
соответственно, ниже, то среда кислая
и наоборот.
При
расчетах [Н+]
удобнее выражать через ВОДОРОДНЫЙ
ПОКАЗАТЕЛЬ
рН –
отрицательный десятичный логарифм
молярной концентрации ионов водорода
в растворе:
рН
= –lg [Н+],
соответственно, рОН
= – lg[ОН¯] и рН
+ рОН = 14 (5)
Величиной рН пользуются для характеристики
разбавленных водных растворов. рН < 7
– среда кислая; рН = 7 – нейтральная; рН
> 7 – щелочная.
Для
приблизительного определения рН среды
служат кислотно-основные ИНДИКАТОРЫ –
слабые органические кислоты или
основания, ионные и молекулярные формы
которых имеют различную окраску,
указывающую на рН среды. Например, в
растворе индикатора метилового оранжевого
устанавливается равновесие:
НInd
⇄
Н+
+ Ind‾,
красный желтый
смещающееся в
зависимости от рН среды.
Универсальный
индикатор – это смесь нескольких
индикаторов, интервал перехода окраски
которых охватывают шкалу рН от 1 до 14.
Точность определения рН не превышает
0,5 единиц рН.
Буферными
называют растворы, поддерживающие
определенную концентрацию ионов водорода
(рН) при разбавлении и незначительно
изменяющие ее при добавлении небольших
количеств сильных кислот или щелочей.
К ним относятся:
1.
Растворы, содержащие слабую кислоту и
соль этой кислоты и сильного основания
(СН3СООН
+ СН3СООNa);
2.
Растворы, содержащие слабое основание
и соль этого основания и сильной кислоты
(NH4OH
+ NH4Cl);
3.
Растворы, содержащие смесь солей слабых
многоосновных кислот (Na2HPO4
+ NaH2PO4);
4.
Растворы, содержащие смесь средней
гидролизующейся соли и кислой соли этой
же кислоты (NaHCO3
+ Na2CO3).
Расчет
рН буферного раствора производят по
универсальной формуле Гендерсона-Гассельбаха:
Покажем,
что буферная смесь, например, СН3СООН
+ СН3СООNa,
обладает способностью в определенных
пределах поддерживать постоянным рН
раствора.
При
прибавлении щелочи произойдет реакция:
СH3COOH
+ NaOH → CH3COONa
+ H2O,
при
этом происходит связывание ионов ОН‾.
При добавлении
кислоты протекает реакция:
HCl
+ CH3COONa
→ CH3COOH
+ NaCl,
т.е.
происходит связывание ионов Н+.
рН буферного
раствора зависит от соотношения
концентраций соли и кислоты. Изменяя
это отношение можно получить буферный
ряд, т.е. серию растворов с последовательно
меняющейся величиной рН.
БУФЕРНОЙ
ЕМКОСТЬЮ
называется количество вещества
эквивалента сильной кислоты или щелочи
(моль), необходимое для смещения рН 1 л
буферного раствора на одну единицу.
,
где
Δ b – количество
добавленной щелочи или кислоты;
рН0
– водородный показатель исходного
буферного раствора;
рН1
– водородный показатель буферного
раствора после прибавления сильной
кислоты или щелочи.
Буферная емкость
раствора тем выше, чем больше концентрации
компонентов и чем меньше эти концентрации
различаются между собой.
Разбавление
раствора не влияет на изменение рН, но
сильно влияет на величину буферной
емкости.
Поддержание
постоянного уровня рН в крови и тканевых
жидкостях достигается благодаря наличию
нескольких буферных систем. Важнейшие
из них:
1. Гидрокарбонатная
буферная система характеризуется
равновесием молекул слабой угольной
кислоты с образующимися при ее диссоциации
гидрокарбонат-ионами:
НСО3‾
+ Н+
⇄
Н2СО3 (1а)
НСО3‾
+ Н2О
⇄
Н2СО3
+ ОН¯ (1б)
В
организме угольная кислота образуется
при гидратации СО2
– продукта окисления органических
веществ:
СО2
+ Н2О
⇄
Н2СО3
Процесс ускоряется
ферментом карбоангидразой.
2. Фосфатная буферная
система характеризуется равновесием:
HPO42ˉ
+ H+
⇄
H2PO4‾ (2а)
НРО42ˉ
+ Н2О
⇄
Н2РО4¯
+ ОН¯ (2б)
3.
Буферная система оксигемоглобин-гемоглобин,
на долю которой приходится приблизительно
75% емкости крови, характеризуется
равновесием между ионами гемоглобина
Нb‾
и самим гемоглобином ННb
(очень слабая кислота, КННb
= 6,3∙10ˉ9;
рКННb
= 8,2):
Нb‾
+ Н +
⇄
ННb (3а)
Нb¯
+ Н2О
⇄
ННb
+ ОН¯, (3б)
а
также между ионами оксигемоглобина
НbО2‾
и самим оксигемоглобином ННbО2
(более сильная кислота, чем ННb
кислота – К (ННbО2)
= 1,12∙10ˉ7,
рК (ННbО2)
= 6,95):
НbО2‾
+ Н+
⇄
ННbО2 (3в)
НbО2
+ Н2О
⇄
ННbО2
+ ОН¯ (3г)
Гемоглобин и
оксигемоглобин связаны равновесием:
ННb
+ О2
⇄
ННbО2
При
поступлении в кровь сильных кислот
значительная часть ионов Н+
тотчас же связывается с ионами НСО3‾,
НРО42ˉ,
Нb‾
и НbО2‾
согласно уравнениям:
NaHCO3
+ HCl ⇄
H2CO3
+ NaCl
Na2HPO4
+ HCl ⇄
NaH2PO4
+ NaCl
КНb + HCl ⇄
ННb + KCl
NaHbО2
+ HCl ⇄
ННbО2
+ NaCl
Эти
же буферные системы ограничивают
возрастание рН при поступлении в кровь
щелочей. Ионы гидроксила взаимодействуют
со свободными Н2СО3,
ННb,
ННbО2
и ионами дигидрофосфата по схемам:
H2CO3
+ NaOH ⇄
NaHCO3
+ H2O
NaH2PO4
+ NaOH ⇄
Na2HPO4
+ H2O
HНb
+ NaOH ⇄
NaНb
+ Н2О
ННbО2
+ NaOH ⇄
NaНbО2
+ Н2О
Таким образом, все
буферные системы крови и тканевых
жидкостей образуют единую взаимосвязанную
систему.
6.
вопросы
ДЛЯ САМОконтроля знаний:
6.1
Слабые электролиты. Степень диссоциации,
константа диссоциации.
6.2 Сильные электролиты. Ионная сила,
коэффициент активности, активность.
6.3
Буферные системы: определение,
классификация и механизм действия.
Расчет рН буферных систем.
6.4
Определение буферной емкости системы.
От каких факторов она зависит?
6.5
Буферные системы крови. Механизм
кислотно-щелочного равновесия в организме
человека.
Соседние файлы в папке Химия
- #
- #
- #
- #
- #
- #
- #
- #
Буферные растворы и их приготовление
Химические процессы, протекающие в тканях организма, особенно с участием ферментов, требуют наличия ряда условий, среди которых важное значение имеет рН среды. Как известно, степень кислотности данного раствора зависит от концентрации ионов Н+ , а степень его щелочности — от концентрации ионов ОН-.
При определенной температуре произведение положительно и отрицательно заряженных ионов -величина постоянная. Зная один из показателей, можно определить другой. Исходя из этого положения, в химии принято обозначать кислотность или щелочность раствора условно через водородный показатель (рН), представляющий логарифм концентрации ионов Н+ , взятый с обратным знаком. Так, при рН 7,0 концентрация ионов Н+ равна концентрации ионов ОН- и раствор имеет нейтральную реакцию. Чем показатель рН меньше 7,0, тем концентрация ионов Н+ выше (ведь показатель с обратным знаком) и тем больше кислотность раствора. Наоборот, чем рН больше 7,0, тем меньше ионов Н+ в растворе и более выражены его щелочные свойства.
Различные ферменты требуют для проявления своей активности разные значения рН.
Так, оптимальное условие для действия щелочной фосфатазы при рН 9,0, тогда как для кислой фосфатазы требуется рН 5,0.
Чтобы обеспечить наилучшие условия для проявления активности гистохимически выявляемого фермента, необходимо, чтобы в среде инкубации поддерживалось значение рН, оптимальное для данного фермента. Это условие достигается введением в среду инкубации буферных смесей с заданными значениями рН. Наиболее распространенными буферными растворами являются фосфатный, ацетатный и трис-буфер.
Приготовление буферных растворов
Прежде чем дать прописи буферных смесей, необходимо напомнить, что для определения концентрации растворов реактивов приняты понятия молярность (М) и нормальность (N).
Молярность раствора (М) — количество грамм-молей вещества, содержащихся в 1 л раствора. Грамм-моль — молекулярная масса данного вещества, выраженная в граммах. Например, для приготовления раствора в концентрации 0,2 М необходимо на 1 л раствора взять вещество в количестве, равном 0,2 его молекулярной массы.
Нормальность (N) — количество грамм-эквивалентов в 1 л раствора.
Грамм-экивалент — количество данного вещества, химически равноценное в данной реакции 1 грамм-атому водорода.
Для сложных веществ — это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Поэтому:
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
|
Пример |
|
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г |
Фосфатный буфер (рН 6,0—8,0).
Растворы:
А — 0,2 М КН2 РО4 (13,6 г соли в 1 л дистиллированной воды);
Б — 0,2 М Na2 НР04 (31,2 г Na2 НРО4 . 2Н2 О в 1л дистиллированной воды).
Для получения 100 мл буфера нужного рН следует слить растворы Аи Б в количествах, указанных в табл. 1.
|
Таблица 1
|
|||||||
|
pH |
6,0 |
6,5 |
7,0 |
7,2 |
7,4 |
7,6 |
8,0 |
|
Раствор, мл |
|||||||
|
А Раствор, мл |
87,9 |
68,7 |
48,8 |
27,4 |
18,2 |
11,5 |
3,1 |
|
Б Раствор, мл |
12,1 |
31,3 |
51,2 |
72,6 |
81,8 |
88,5 |
96,9 |
Ацетатный буфер (рН 3,6—5,6).
Растворы:
А — 0,5N СН3 СООН (30 мл ледяной уксусной кислоты долить к 970 мл дистиллированной воды);
Б — O,5N CH3 COONa (68 г соли растворить в 1 л дистиллированной воды).
Слить растворы А и Б в количествах, указанных в табл. 2.
|
Таблица 2
|
|||||||||||
|
рH |
3,6 |
3,8 |
4,0 |
4,2 |
4,4 |
4,6 |
4,8 |
5,0 |
5,2 |
5,4 |
5,6 |
|
Раствор, мл |
|||||||||||
|
А |
185 |
176 |
164 |
147 |
126 |
102 |
80 |
59 |
42 |
29 |
19 |
|
Б |
15 |
24 |
36 |
53 |
74 |
98 |
120 |
141 |
158 |
171 |
181 |
Трис-буфер (рН 7,2 — 9,0).
Растворы:
А — 0,2 М трис (оксиметил)-аминометана (24,3 г соли в 1 л дистиллированной воды);
Б — 0,1N НСI.
Слить указанные количества растворов А и Б и долить до 100 мл дистиллированной водой (табл. 3).
Как исходные растворы, так и сами буферные смеси могут храниться длительное время. Однако во избежание ошибок (качество реактивов, неточность при составлении)
|
Таблица 3
|
|||||||
|
РН |
7,2 |
7,4 |
7,6 |
7,8 |
8,0 |
8,5 |
9,0 |
|
Раствор, мл |
|||||||
|
Раствор А |
25 |
25 |
25 |
25 |
25 |
25 |
25 |
|
Раствор Б |
43 |
40 |
35,7 |
30,6 |
25 |
12 |
5 |
|
Вода дистиллированная |
32 |
35 |
39,3 |
44,4 |
50 |
63 |
70 |
0,1 М ФОСФАТНЫЙ БУФЕР, pH 5,7—8,0
МАТОЧНЫЙ РАСТВОР «
А) 0,2М раствора NaН2Р04*Н20 (27,58 г/1000мл)
Б) 0,2 М раствора Na2НР04 (28,38 г/1000 мл)
Х мл раствора А + Y мл раствора В + Дистиллированная вода до 200мл
|
рH |
А |
Б |
|
5,7 |
93,5 |
6,5 |
|
5,8 |
92,0 |
8,0 |
|
5,9 |
90,0 |
10,0 |
|
6,0 |
87,7 |
12,3 |
|
6,1 |
85,0 |
15,0 |
|
6,2 |
81,5 |
18,5 |
|
6,3 |
77,5 |
22,5 |
|
6,4 |
73,5 |
26,5 |
|
6,5 |
68,5 |
31,5 |
|
6,6 |
62,5 |
37,5 |
|
6,7 |
56,5 |
43,5 |
|
6,8 |
51,0 |
49,0 |
|
6,9 |
45,0 |
55,0 |
|
7,0 |
39,0 |
61,0 |
|
7,1 |
33,0 |
67,0 |
|
7,2 |
28,0 |
72,0 |
|
7,3 |
23,0 |
77,0 |
|
7,4 |
19,0 |
81,0 |
|
7,5 |
16,0 |
84,0 |
|
7,6 |
13,0 |
87,0 |
|
7,7 |
10,5 |
90,5 |
|
7,8 |
8,5 |
91,5 |
|
7,9 |
7,0 |
93,0 |
|
8,0 |
5,3 |
94,7 |
|
7,9 |
7,0 |
93,0 |
|
8,0 |
5,3 |
94,7 |
Примечание.
Если требуется приготовить буферный раствор иной молярности, чем указано в настоящем руководстве, то следует изменить лишь молярность исходных растворов, количественные же их соотношения для получения рН остаются неизменными.
рН приготовленных буферных растворов перед употреблением следует проверять. Грубая проверка может быть осуществлена с помощью индикаторной бумаги, более точная — посредством специального прибора-потенциометра (рН-метр).
ИНСТРУКЦИЯ
ПО ПРИГОТОВЛЕНИЮ БУФЕРНОГО РАСТВОРА — РАБОЧЕГО ЭТАЛОНА
pH 1 РАЗРЯДА ИЗ СТАНДАРТ-ТИТРА
В.1 Рабочий эталон pH готовят растворением содержимого стандарт-титра СТ-pH-1-6 в воде.
Срок хранения свежеприготовленной воды — не более 6 ч.
Примечание — При подготовке стеклянной посуды к работе не допускается использование синтетических моющих средств.
В.2 Стандарт-титр переносят в мерную колбу по ГОСТ 1770 (далее — колба) вместимостью, указанной на этикетке флакона.
Для этого необходимо:
— извлечь флакон из полиэтиленового пакета, вставить в колбу воронку;
— осторожно снять крышку с флакона над воронкой и высыпать в воронку содержимое флакона;
— с помощью промывалки промыть над воронкой внутренние поверхности крышки и флакона до полного удаления вещества с указанных поверхностей;
— заполнить колбу водой, не долив до метки 5 — 10 см, взбалтывать до полного растворения содержимого;
— в течение 30 мин термостатировать колбу в водяном термостате при (20,0 +/- 0,2) °C;
— довести водой объем раствора в колбе до метки, закрыть пробкой и тщательно перемешать содержимое.
После приготовления рабочих эталонов следует перелить их в емкости для хранения.
В.3 Хранение рабочего эталона pH
Рабочий эталон pH должен быть защищен от действия прямых солнечных лучей и должен храниться в плотно закрытой стеклянной или пластмассовой (полиэтиленовой) посуде в затемненном месте при температуре не выше 25 °C.
Срок хранения — 1 неделя с момента приготовления.
Приложение Г
(обязательное)
Скачать документ целиком в формате PDF


